|
|
Texto ilustrado e linkado |
|
|
|
Texto ilustrado e linkado |
|
| Estes dois
tumores foram descritos
independentemente e ainda são considerados entidades distintas por
vários autores. Na classificação
da OMS de 2007 dos tumores do sistema nervoso central, figuram
entre os tumores mesenquimatosos das meninges, mas em capítulos
separados, com códigos ICD-O* diferentes. A graduação
histológica é dada como grau II nos hemangiopericitomas (grau
III nos anaplásicos). Ao tumor fibroso solitário não
é atribuído grau. * ICD-O (International Classification
of Diseases for Oncology) : código 8815/0 para TFS e 9150/1 para
HPC, sendo que o dígito 0 significa benigno, e 1 incerteza sobre
benignidade / malignidade ou baixa malignidade.
Já na classificação da OMS de 2013 dos tumores ósseos e de partes moles, as duas entidades são fundidas, e o termo hemangiopericitoma é considerado sinônimo obsoleto do tumor fibroso solitário. Hoje há bases moleculares sólidas apoiando a identidade dos dois. No site, havíamos definido casos de hemangiopericitoma com base nas imagens de flow void proeminentes na ressonância magnética e na positividade para CD34 nos TFS e negatividade nos HPC. Contudo, ao reanalisar nosso material, ficou claro o alto grau de imbricamento morfológico entre ambos. Aqui, apresentamos uma súmula dos casos de cada diagnóstico, com o entendimento de que distinção entre TFS e HPC é, na realidade, artificial. Clique para textos sobre tumor fibroso solitário e hemangiopericitoma (1) (2) e para novos textos sobre tumor fibroso solitário do SNC e extrapleural. A seguir,
nossa experiência em 7 casos de TFS e 3 casos de HPC :
|
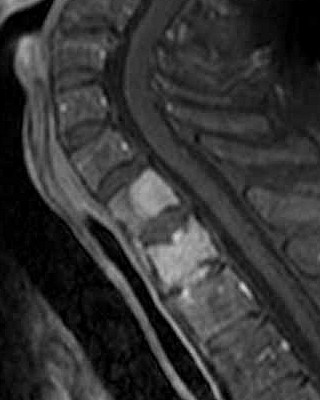
| Exemplos com metástases ósseas tardias. | |||
 |
 |
 |
 |
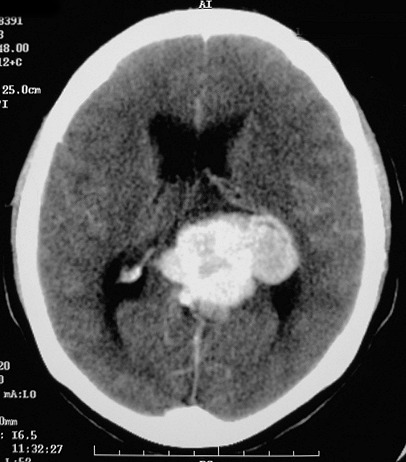
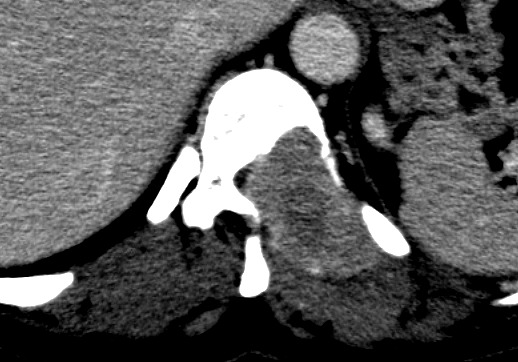
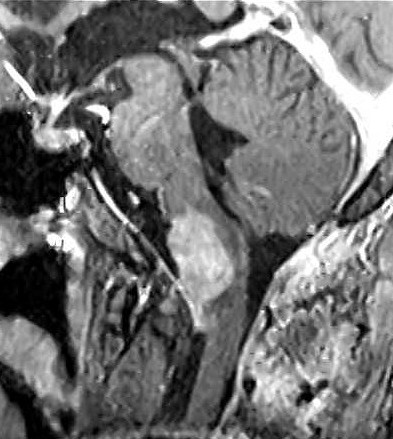
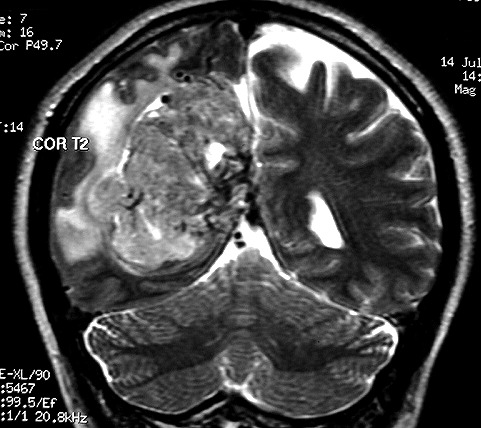
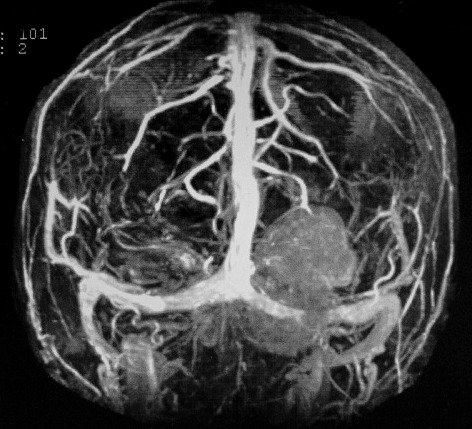
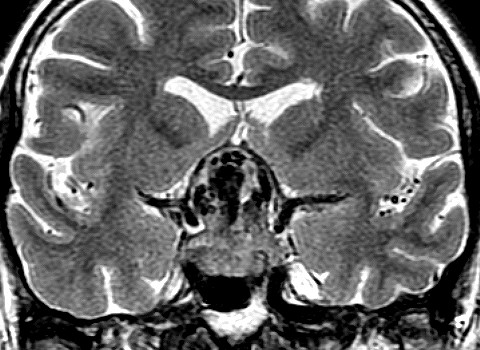
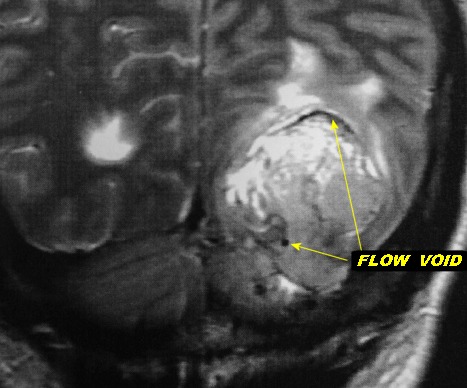
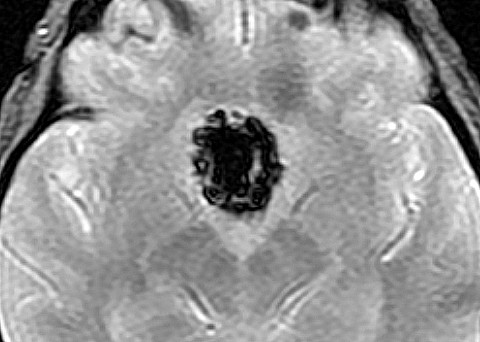
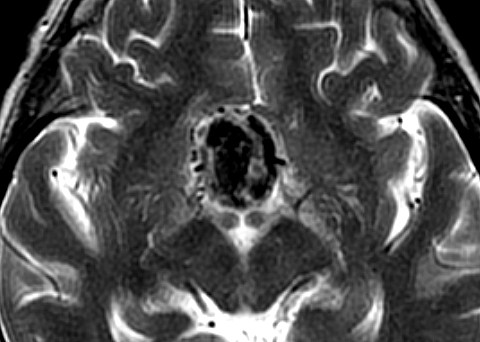
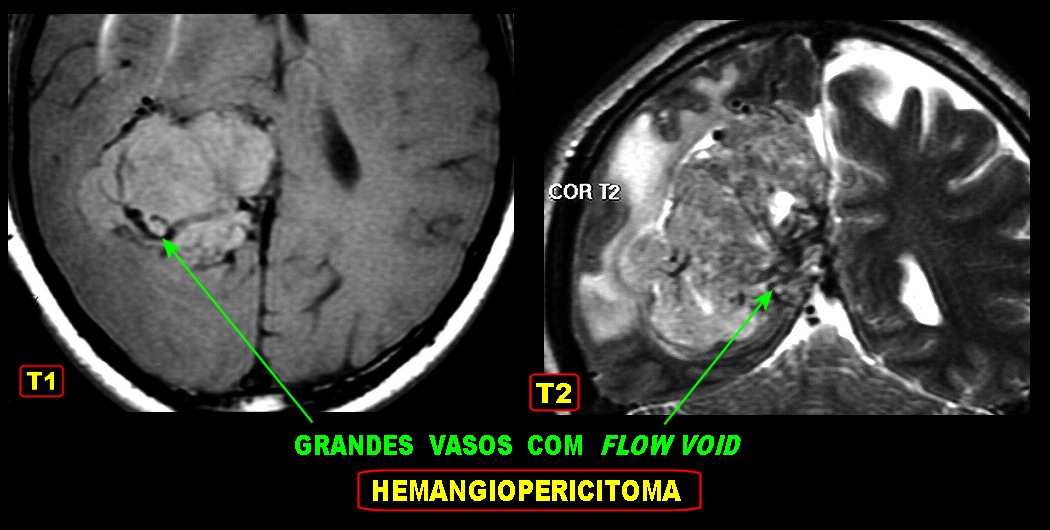
| Hemangiopericitoma (HPC). Destaques, exames de imagem. Tumores sólidos implantados na dura-máter, com proeminentes imagens de flow void, um deles com infiltração do seio transverso | ||
 |
 |
 |
| Tumor fibroso solitário (TFS). Destaques, imunohistoquímica. | |||
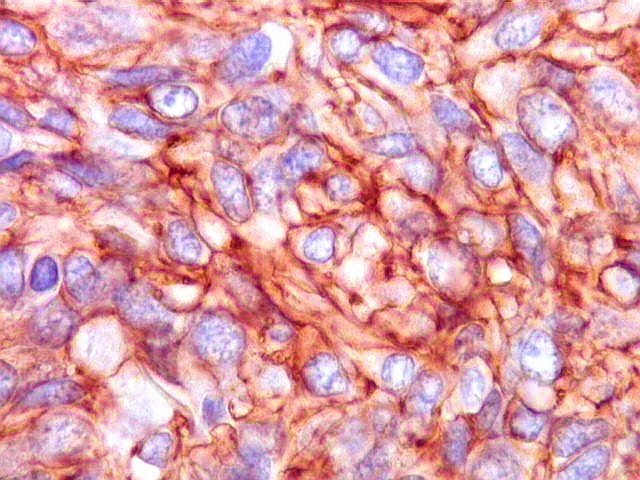
| CD34. Positivo em células neoplásicas, padrão membrana e citoplasmático | CD34. Positivo em células endoteliais, evidencia a riquíssima vascularização do tumor | CD99. Positivo em células neoplásicas, padrão membrana e citoplasmático | BCL-2. Positividade citoplasmática nas células neoplásicas |
 |
 |
 |
 |
| VIM. Positividade citoplasmática nas células neoplásicas | Ki-67. Marca cerca de 10% dos núcleos das células neoplásicas | AE1AE3. Positividade em células neoplásicas isoladas | 1A4. Positividade em vasos e células neoplásicas isoladas |
 |
 |
 |
|
| Outros anticorpos com positividade focal e/ou ocasional : EMA, desmina, HHF-35, S-100, p53. | |||
| Hemangiopericitoma (HPC). Destaques, imunohistoquímica. | |||
| CD34. Positivo em células endoteliais, evidencia a riquíssima vascularização do tumor | CD34. Positividade em células neoplásicas focal e restrita a poucas áreas | CD99. Positivo em células neoplásicas, padrão membrana e citoplasmático | BCL-2. Positividade citoplasmática nas células neoplásicas |
 |
|||
| VIM. Positividade citoplasmática nas células neoplásicas | EMA. Positividade rara em células isoladas | Ki-67. Marca cerca de 10% dos núcleos das células neoplásicas | p53. Marca alta proporção dos núcleos das células neoplásicas |
 |
 |
||
| Destaques de microscopia eletrônica (2 casos). | |||
| Todas as figuras estão linkadas à página original de cada caso. |
|
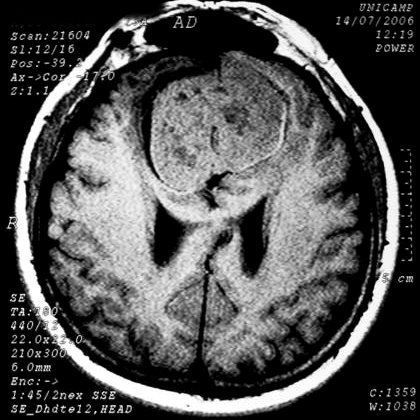
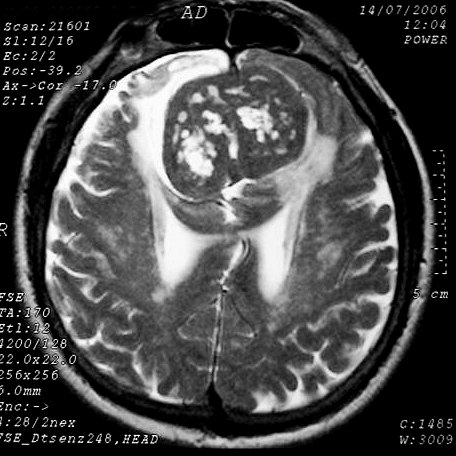
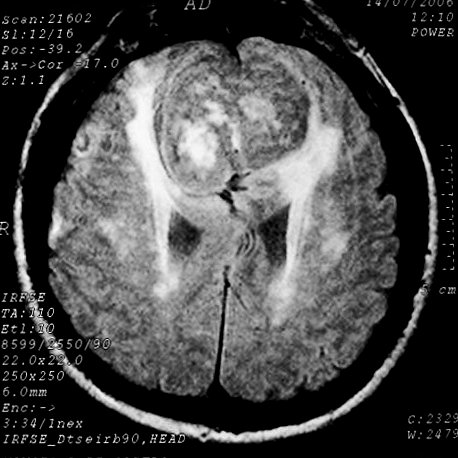
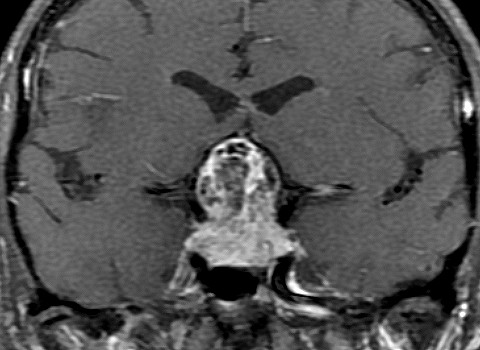
EXAMES DE IMAGEM, EXEMPLOS |
| T1 SEM CONTRASTE | T2 | FLAIR |
 |
 |
 |
| T2 | T1 COM CONTRASTE | |
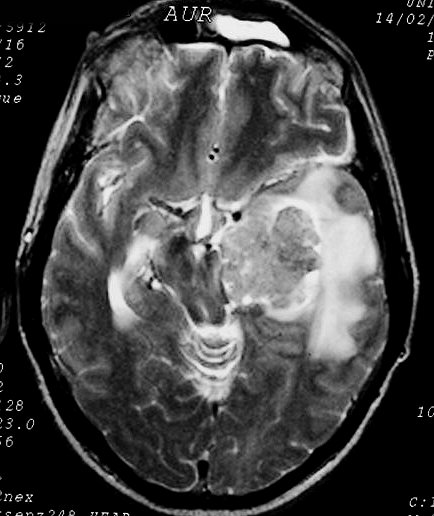 |
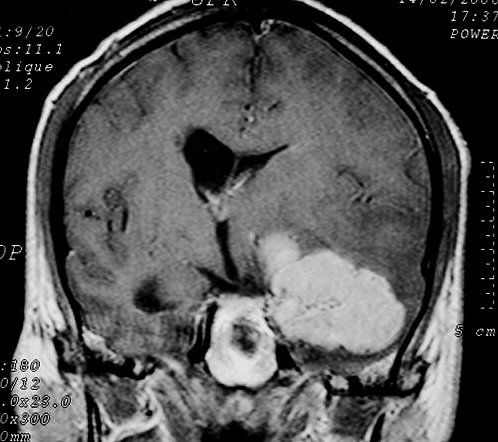 |
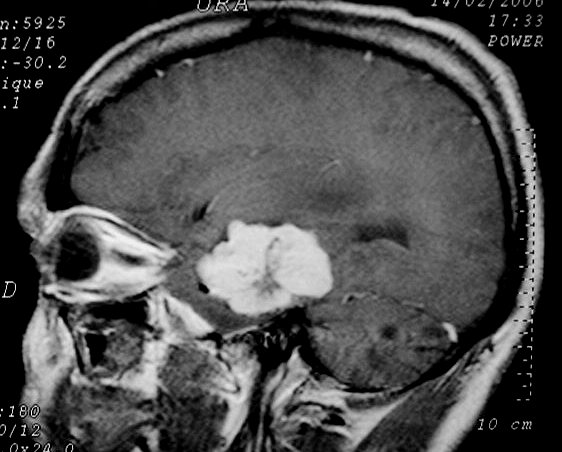 |
| RM T1 COM CONTRASTE | T2 | FLAIR |
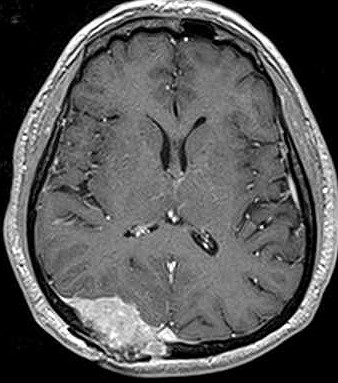 |
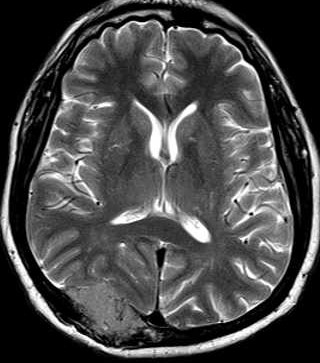 |
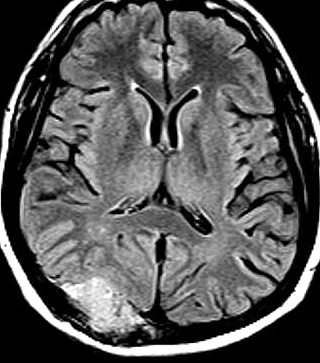 |
| T1 COM CONTRASTE | T1 SEM CONTRASTE | T1 COM CONTRASTE |
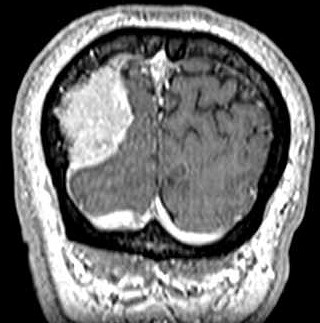 |
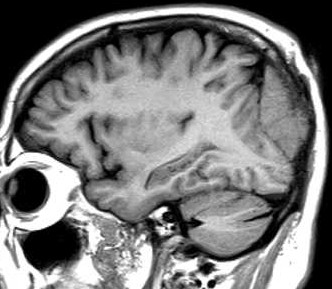 |
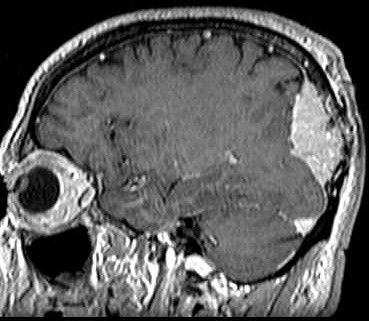 |
|
casos com primário intracraniano e metástases ósseas tardias |
| Fem. 37 a. Parestesia e perda de força muscular em braço e perna direitos desde nov 2008. Cefaléia occipital constante. TC em jan 2009 mostrou massa expansiva parietal esquerda. Cirurgia - tumor firme com 5 cm. de diâmetro. Radioterapia entre abril e julho de 2009, dose total de 6000 cGy. Melhora da cefaléia e recuperação da força muscular. Em dez 2011 dores ósseas difusas e tumores na região esternal (6 cm), linha axilar posterior esquerda e subcostais, crescimento progressivo. Há 15 dias paraparesia e hipoestesia em membros inferiores. Ultrassonografia e cintilografia ósseas. Lesões em região esternal, clavicular esquerda, 4º arco costal esquerdo e 4 nódulos pulmonares. TC jan 2012 - lesão lítica em vértebra T11 e lesões insuflantes em outros ossos do tórax. |
| RM. Axial, Coronal, T1 com contraste | Sagital, T1 sem contraste | |
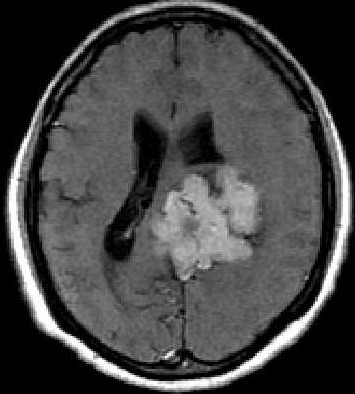 |
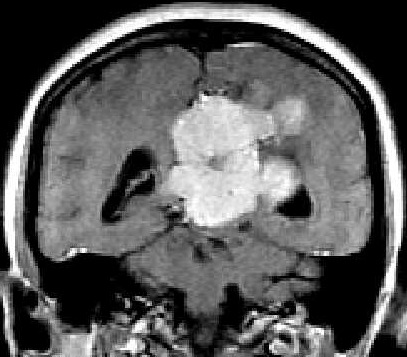 |
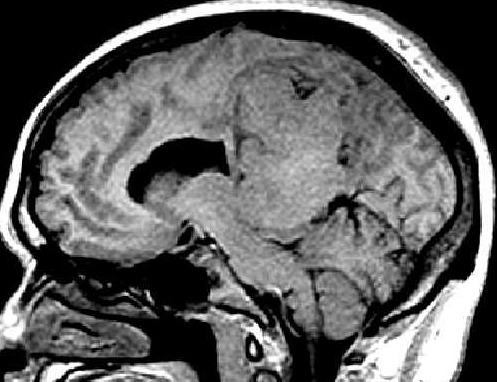 |
| Axiais com contraste | Janela óssea | |
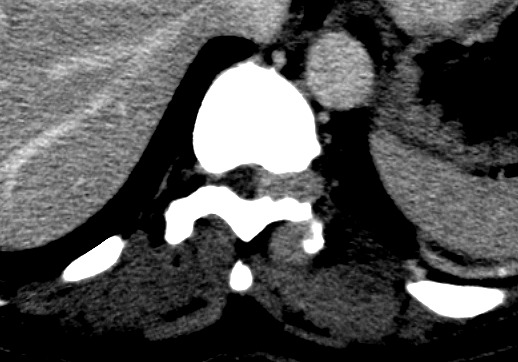 |
 |
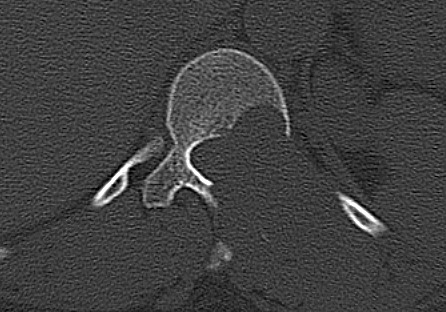 |
| Coronal | Sagitais | |
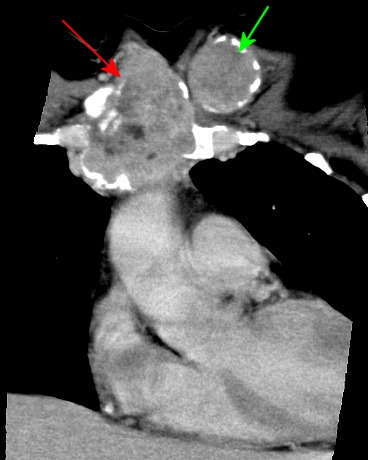 |
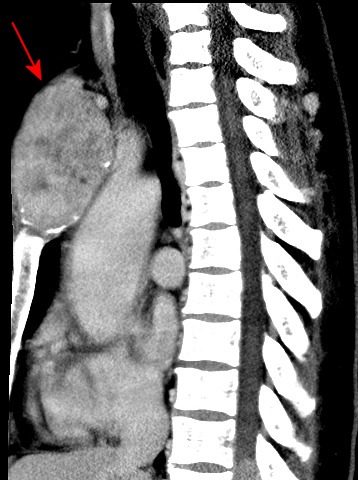 |
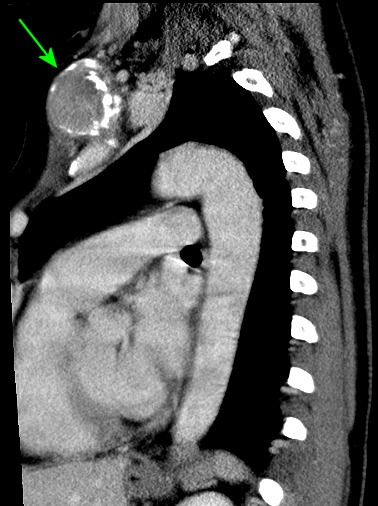 |
| Coronais, lesões em escápula esquerda, 4o. arco costal esquerdo, vértebra T11 | ||
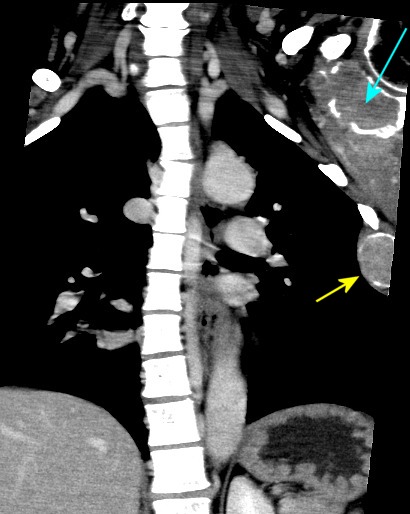 |
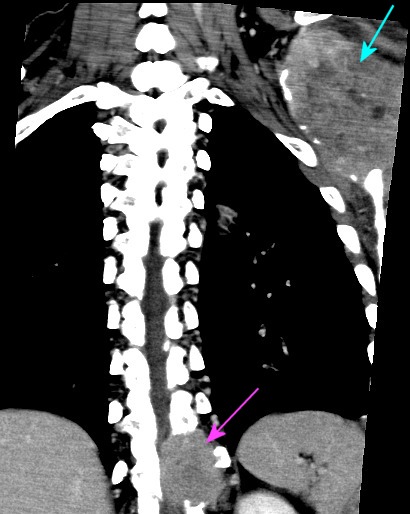 |
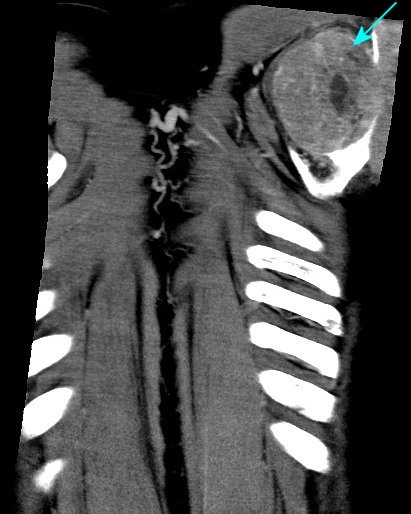 |
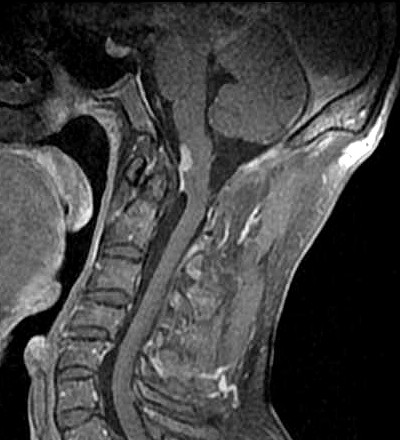
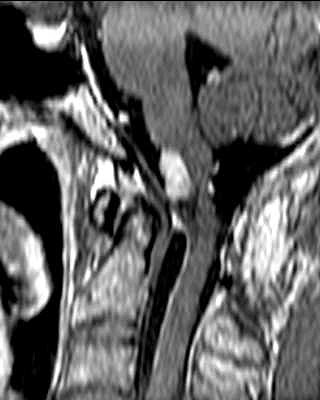
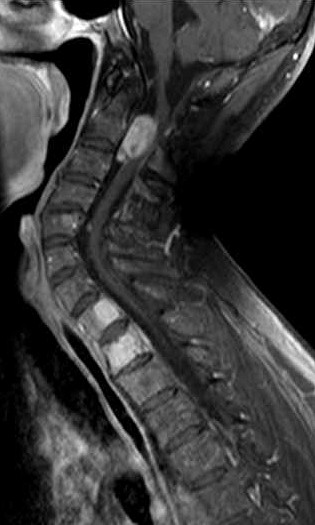
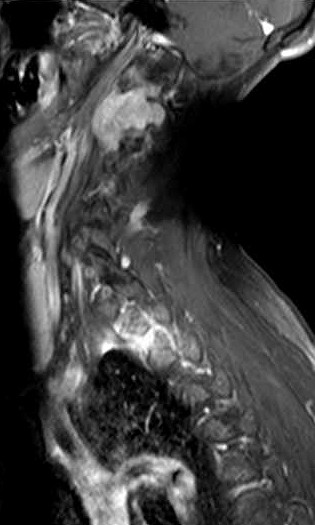
| Masc. 52 a. História iniciada em 2004 (aos 42 anos) com cervicalgia progressiva, seguida por dificuldades motoras em membros superiores. Foi operado 4 vezes, em 2007, 2009, 2011 e 2014, para remoção de tumor na transição occipito-cervical, com componentes intra- e extracranianos. Amostras anátomo-patológicas foram dadas como hemangiopericitoma (1a.) e tumor fibroso solitário (2a. , 3a. e 4a.) História clínica em detalhe. |
| T1 COM CONTRASTE - 4 MOMENTOS. | ||
| 1/2008, 10 meses após primeira cirurgia | 7/2008, evolução | 3/2009, 1 mês após segunda cirurgia |
 |
 |
 |
| 10/2014, após terceira cirurgia em 2011, e imediatamente antes da quarta intervenção. | ||
 |
 |
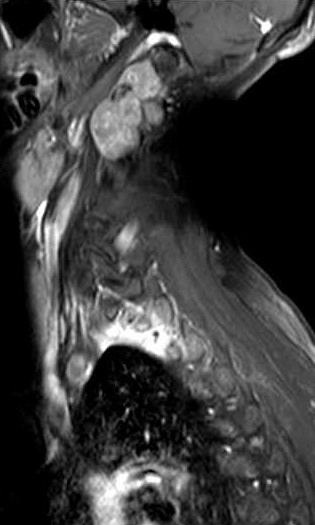 |
| Detalhes, lesão vertebral. T1 | T1 COM CONTRASTE | T2 |
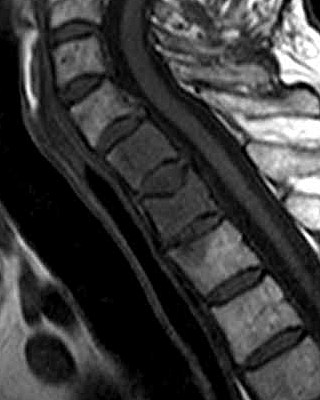 |
 |
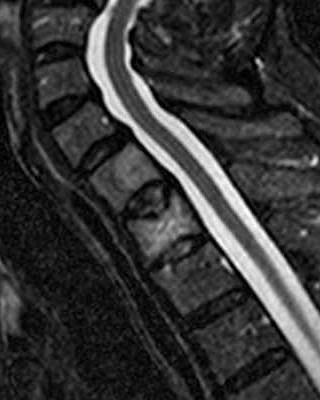 |
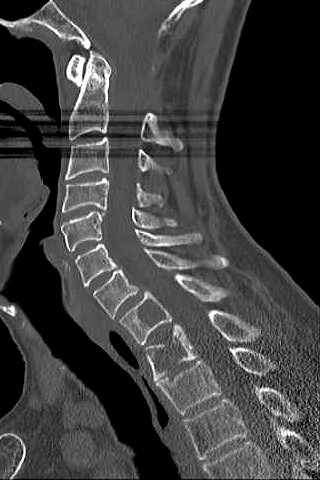
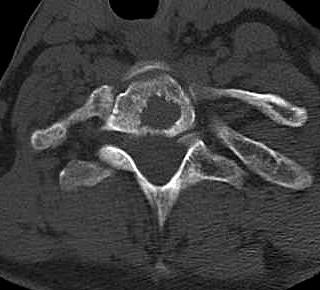
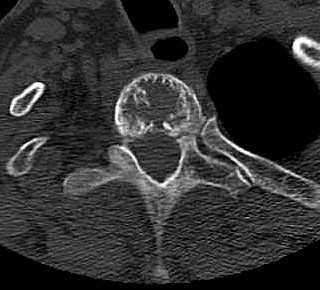
| TC 10/14 - sem contraste | Janela óssea | |
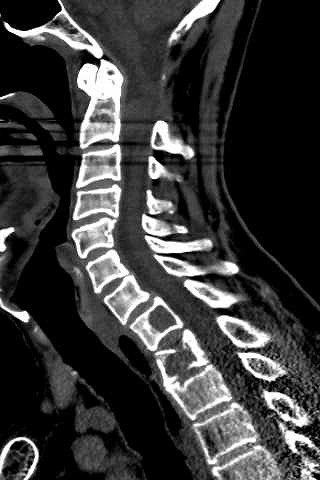 |
 |
 |
 |
||
|
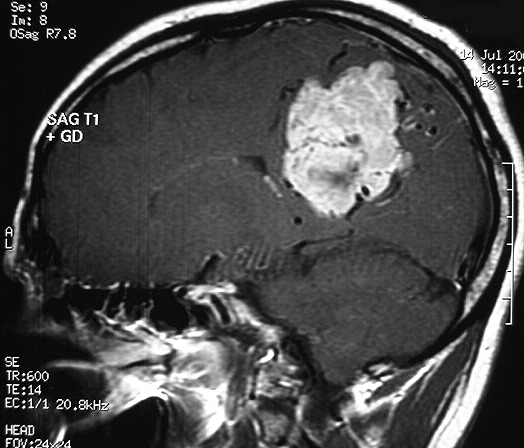
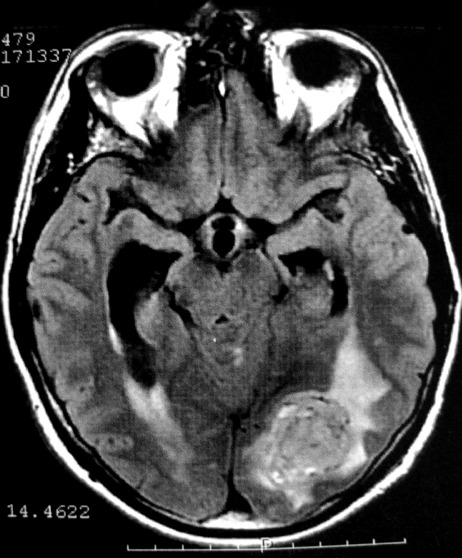
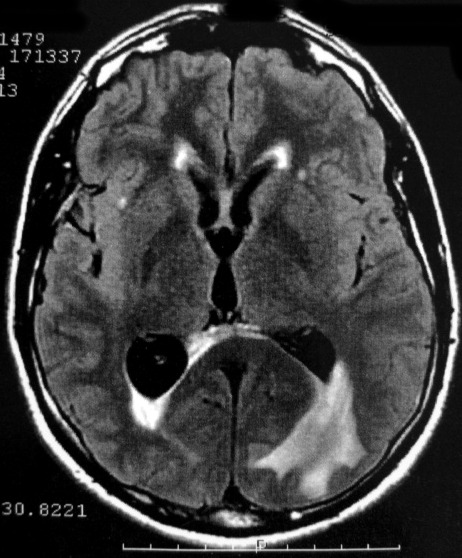
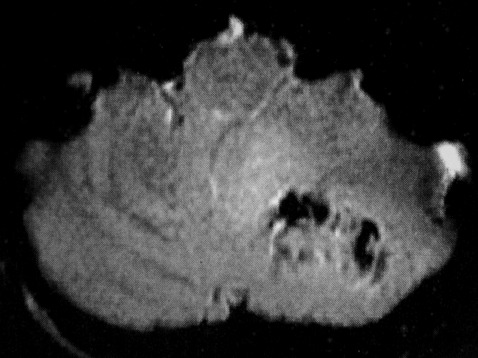
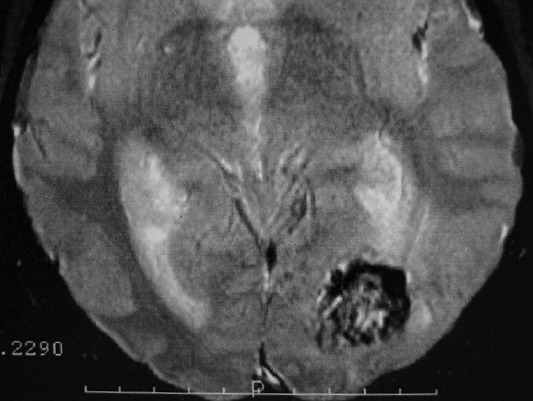
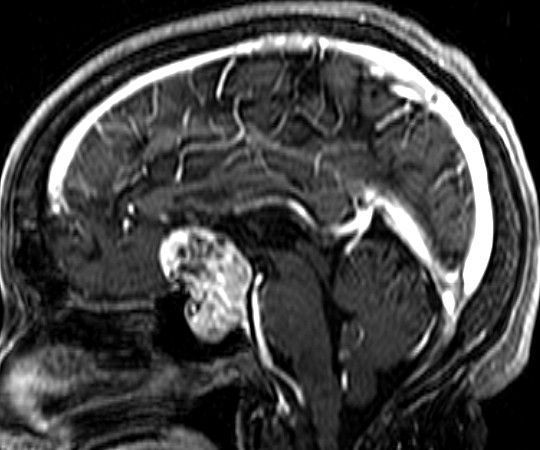
EXAMES DE IMAGEM, EXEMPLOS |
| T2 | T1 COM CONTRASTE |
 |
 |
| FLAIR | GRADIENTE | |
 |
 |
 |
 |
||
| CORONAL T2. | SAGITAL T1. | |
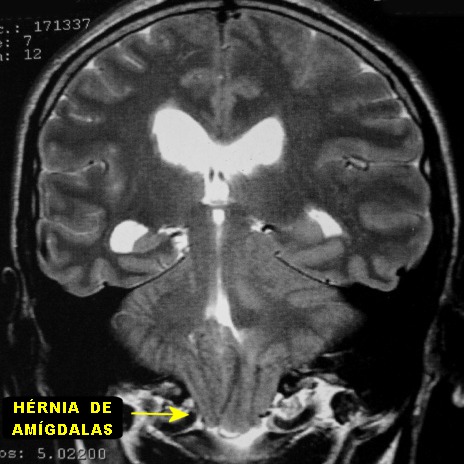 |
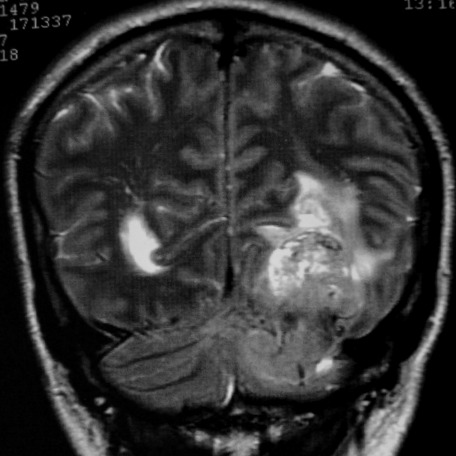 |
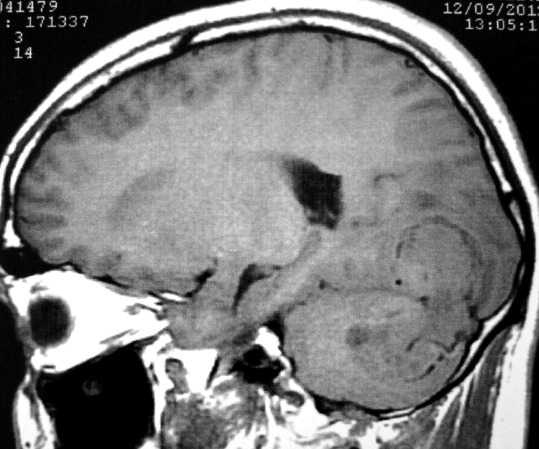 |
| GRADIENTE | T2 | Angioressonância venosa. |
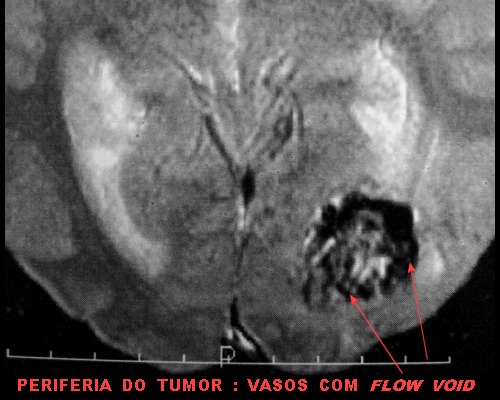 |
 |
 |
| GRADIENTE | T2 | |
 |
 |
 |
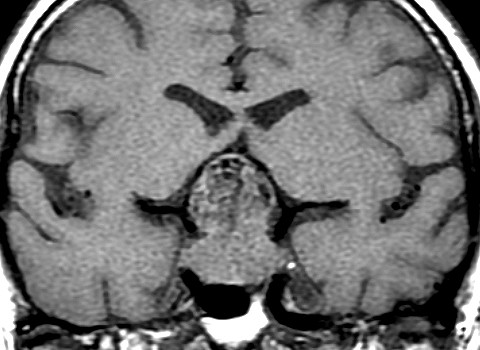
| T1 COM CONTRASTE | T1 COM CONTRASTE | |
 |
 |
 |
|
NEUROPATOLOGIA |
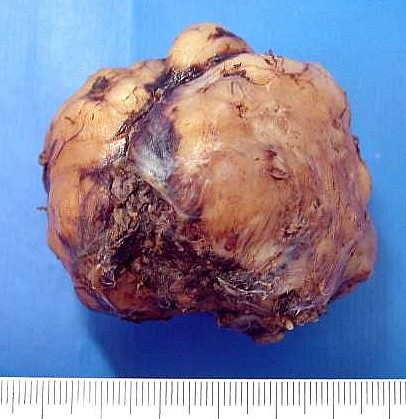
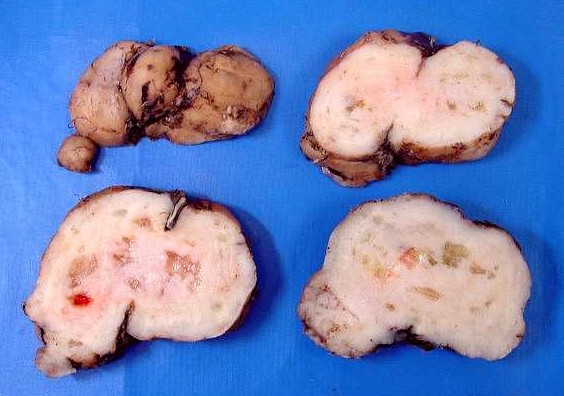
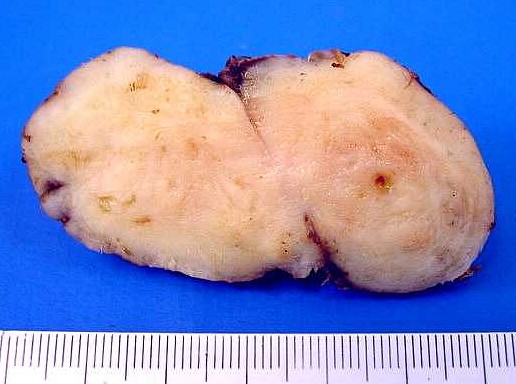
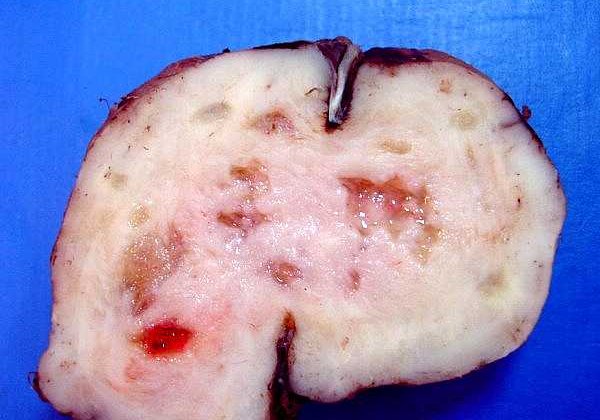
| Macroscopia. Massa neoplásica bem delimitada, firme, superfície externa lisa, aderida à foice do cérebro. Aos cortes, textura fasciculada com pequenos cistos. O aspecto é indistinguível de um meningioma. |
 |
 |
 |
 |
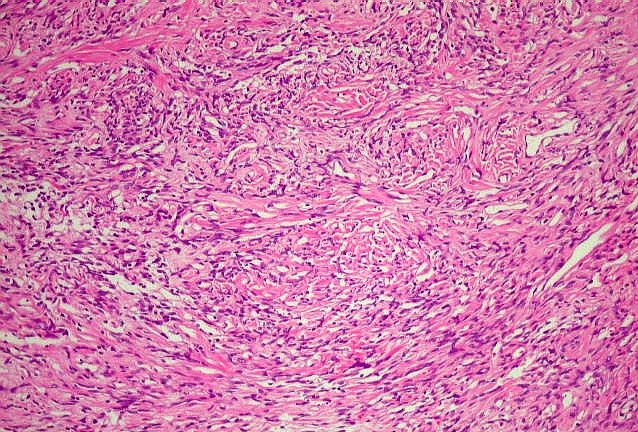
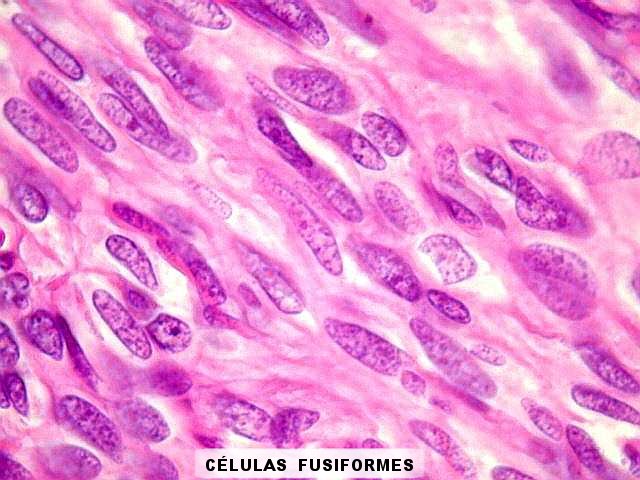
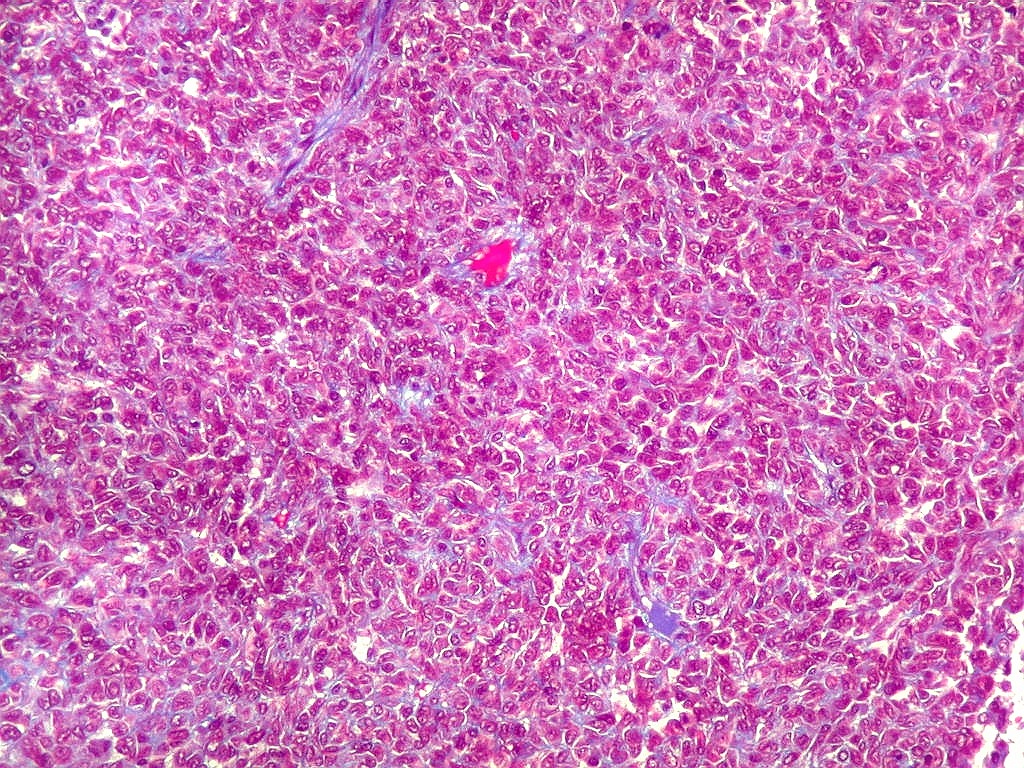
| Histologia - HE. A seguir, campos fotografados de 5 casos de tumor fibroso solitário. Mostram neoplasia fusocelular, cujas células formam feixes multidirecionados, que mudam de direção abruptamente (aspecto estoriforme). As células têm núcleos ovalados, regulares, cromatina bem distribuída, e citoplasma róseo escasso de limites imprecisos. São mescladas a quantidades variáveis de fibras colágenas. Não se notam áreas de necrose. Atipias nucleares e figuras de mitose são incomuns. |
 |
|
 |
|
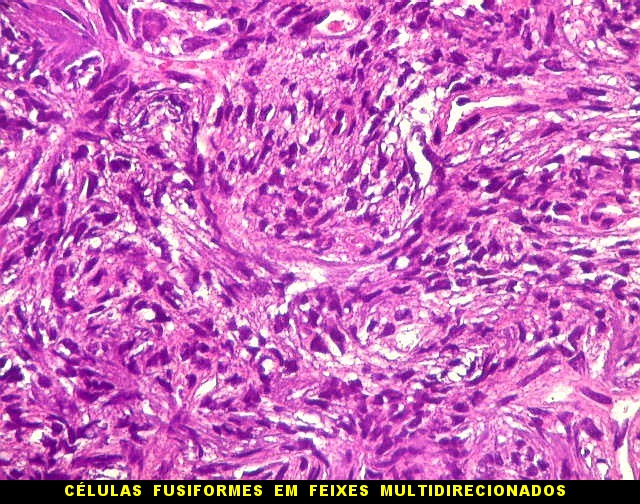 |
 |
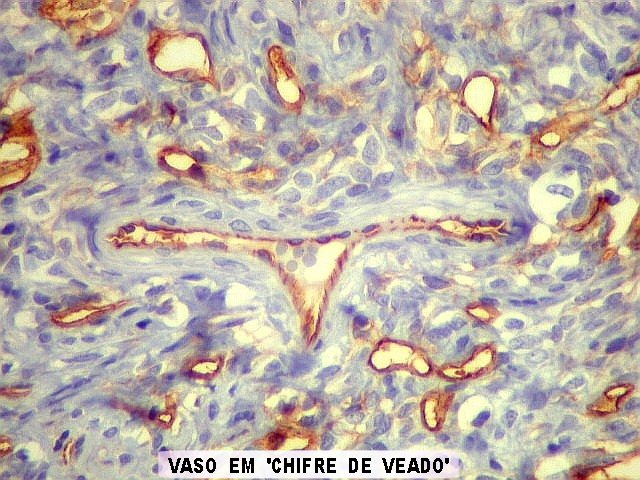
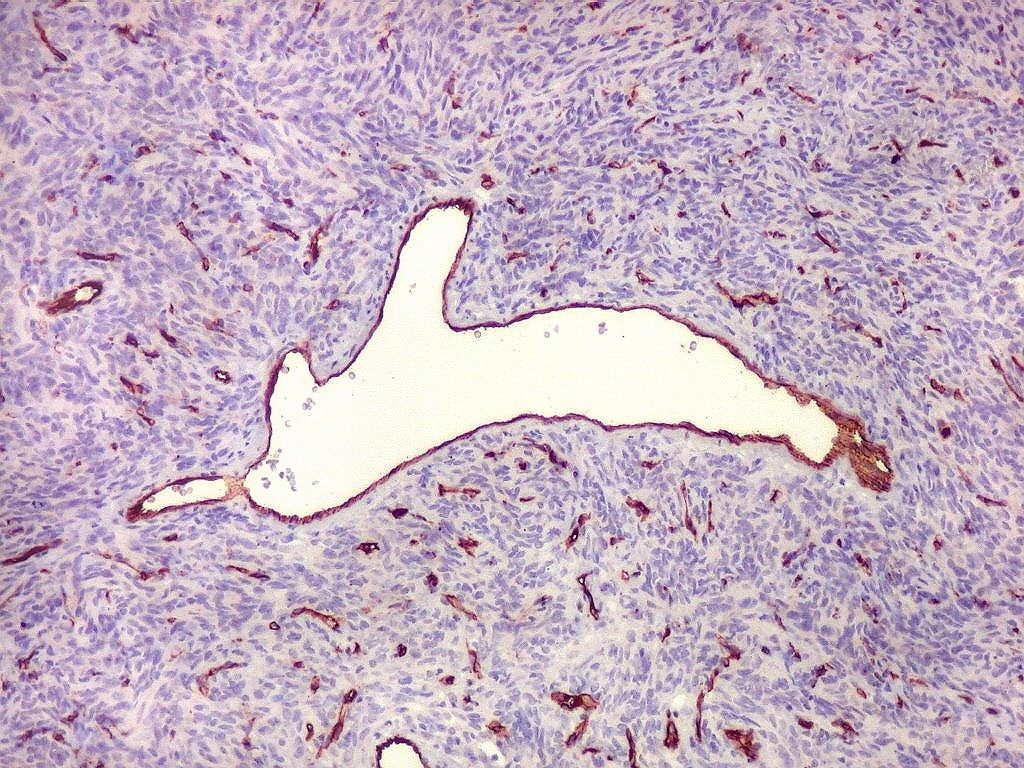
| Vasos calibrosos dilatados. No tumor fibroso solitário observam-se em áreas vasos calibrosos, de luz ampla, mas paredes muito delgadas. Os vasos ramificam-se irregularmente, lembrando o padrão em chifres de veado considerado clássico dos hemangiopericitomas. Não há distinção nítida com vasos semelhantes encontrados nestes últimos. | |
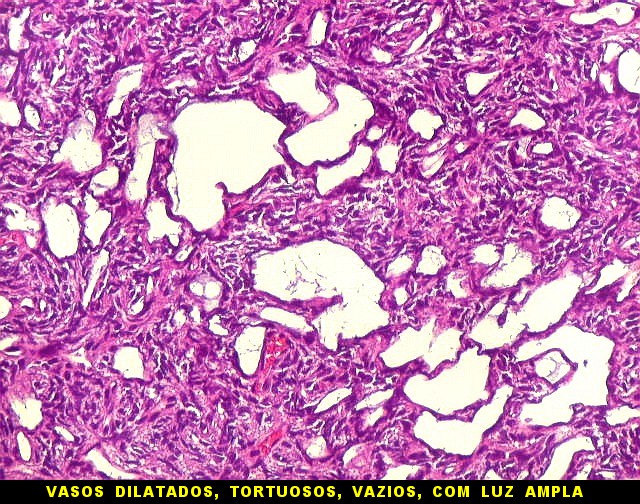 |
 |
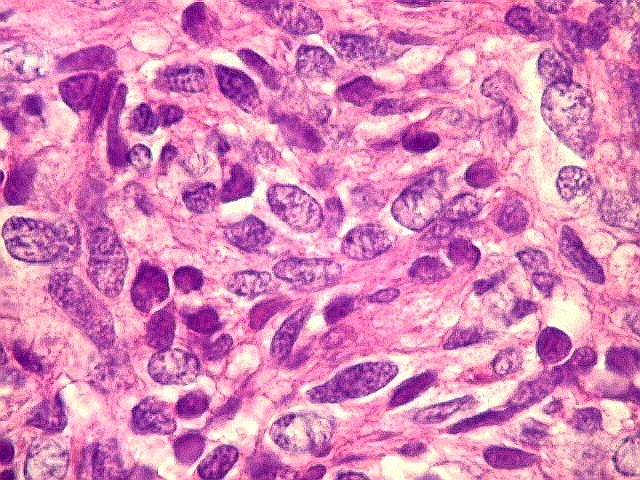
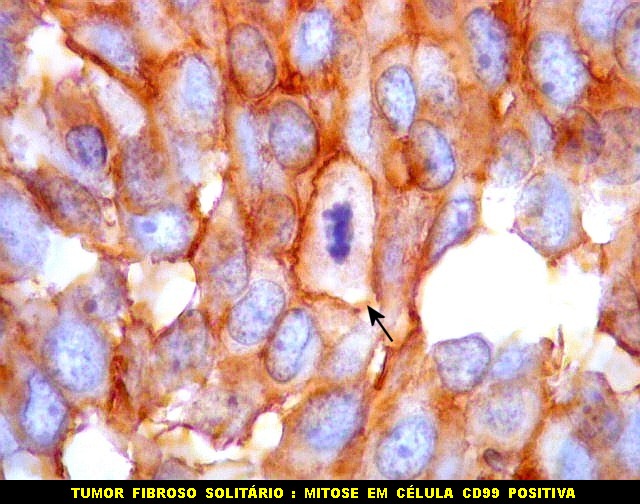
| Mitoses. Mitoses são escassas no tumor fibroso solitário, e geralmente típicas. Aumento do número de mitoses sugere maior agressividade, sendo considerado o fator de maior valor prognóstico nos hemangiopericitomas de partes moles. Só em um caso com 3 recidivas observamos mitoses flagrantemente atípicas. | |
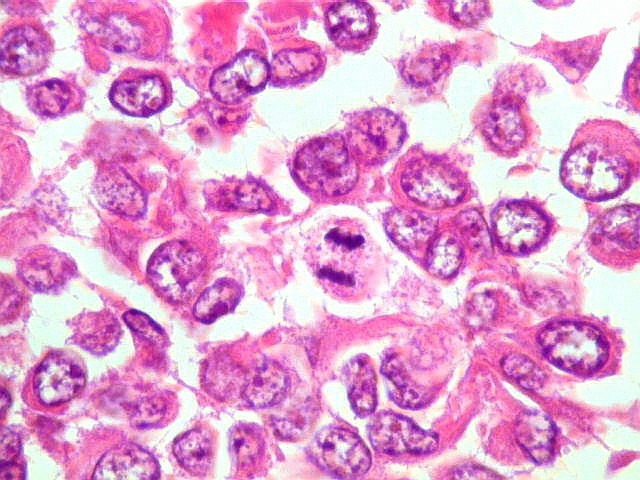 |
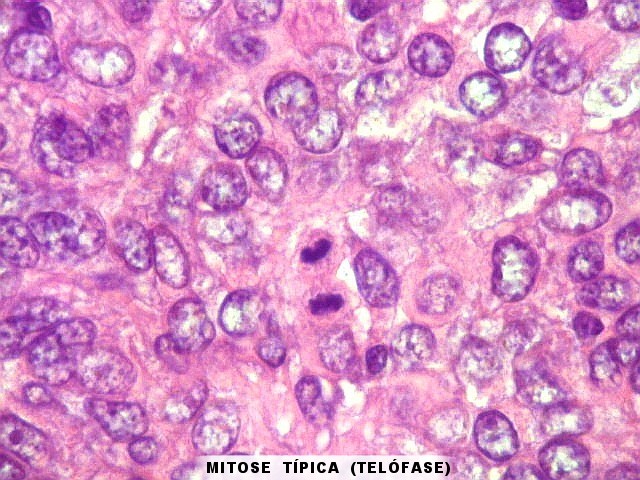 |
| Outros padrões celulares / arquiteturais menos comuns. | |
| Áreas frouxas / mixóides. | Áreas degeneradas / císticas. |
| Células redondas / soltas / aspecto rabdóide. | |
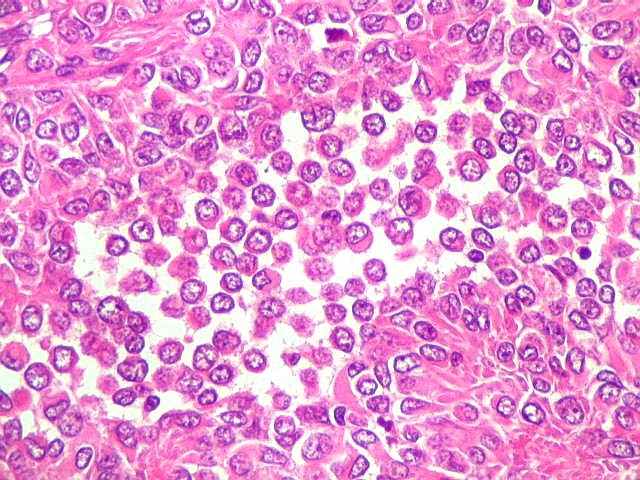 |
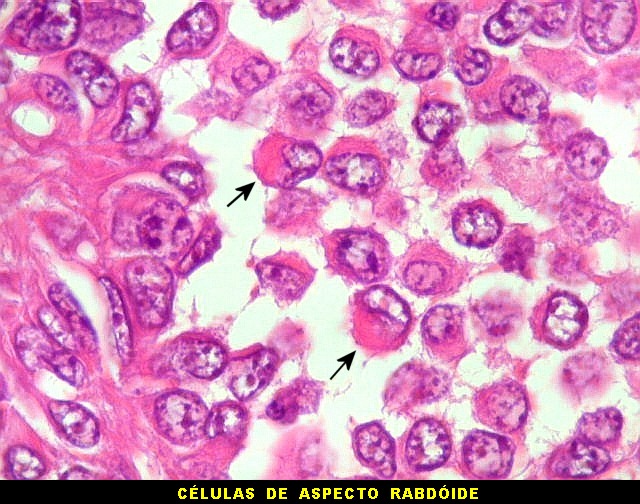 |
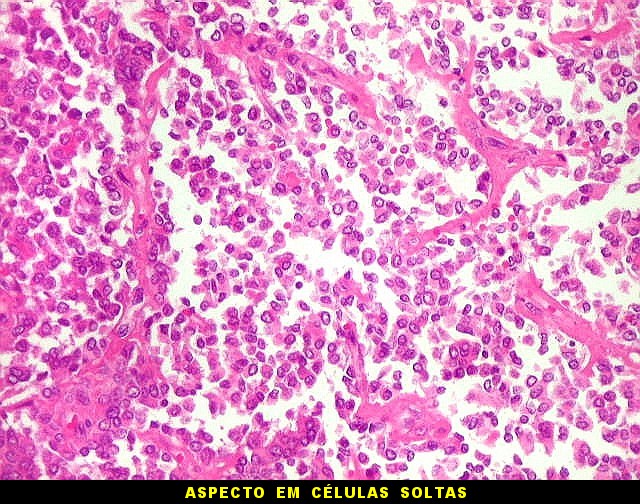 |
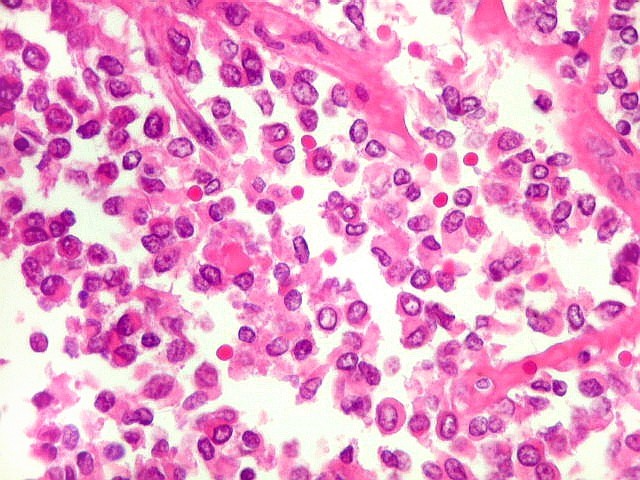 |
| Aspecto pseudoglandular. | Aspecto pseudopapilífero. |
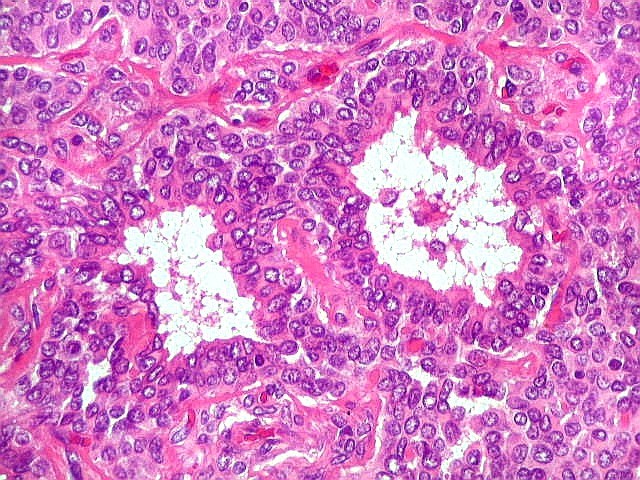 |
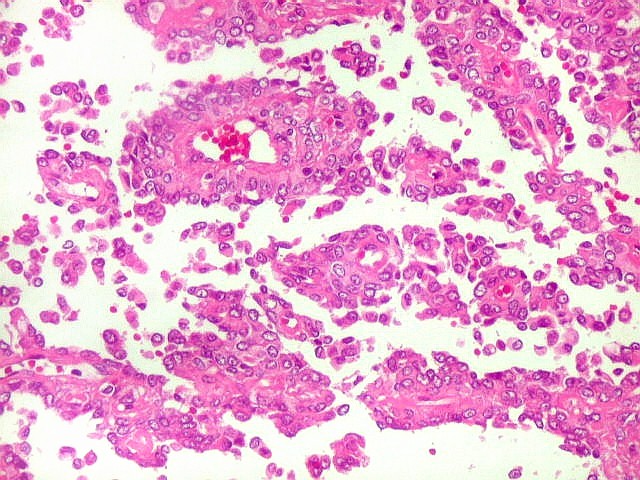 |
| Atipias nucleares. Mitoses atípicas. Foram encontradas em um único caso com 10 anos de evolução no total, no espécime mais recente. | |
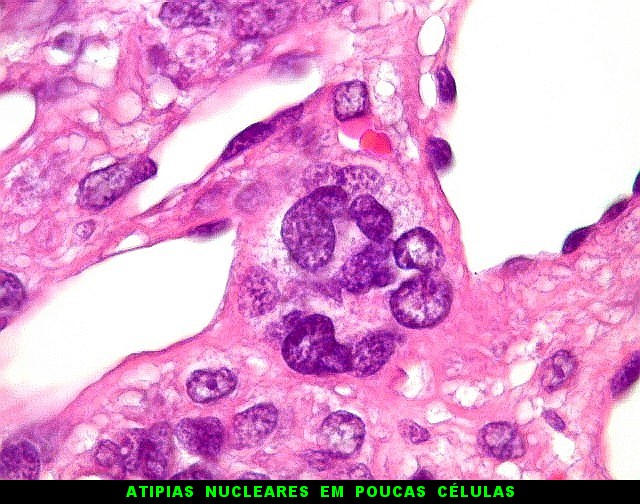 |
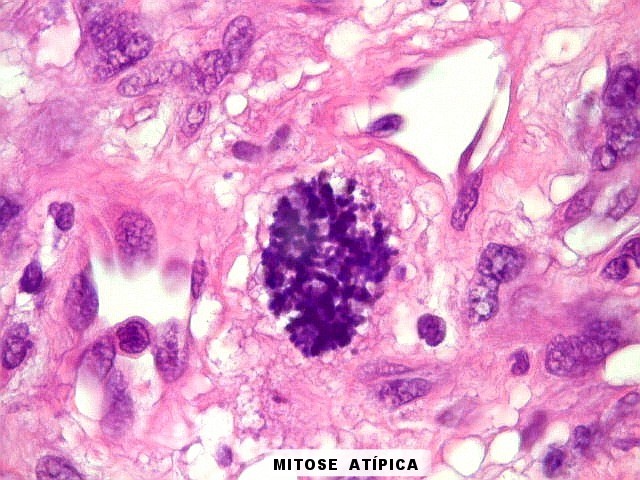 |
| Limite tumor cérebro. Nos poucos casos em que foi possível estudar, o limite era nítido, sem infiltração do tecido cerebral. Contudo, em um caso classificado como hemangiopericitoma, observamos infiltração do tecido cerebral em lingüetas. | Infiltração dural. Constatada em um caso de TFS e outro de hemangiopericitoma. A dura-máter fica totalmente envolvida pelo tumor e células neoplásicas permeiam entre os feixes colágenos. Ver também no tricrômico de Masson. |
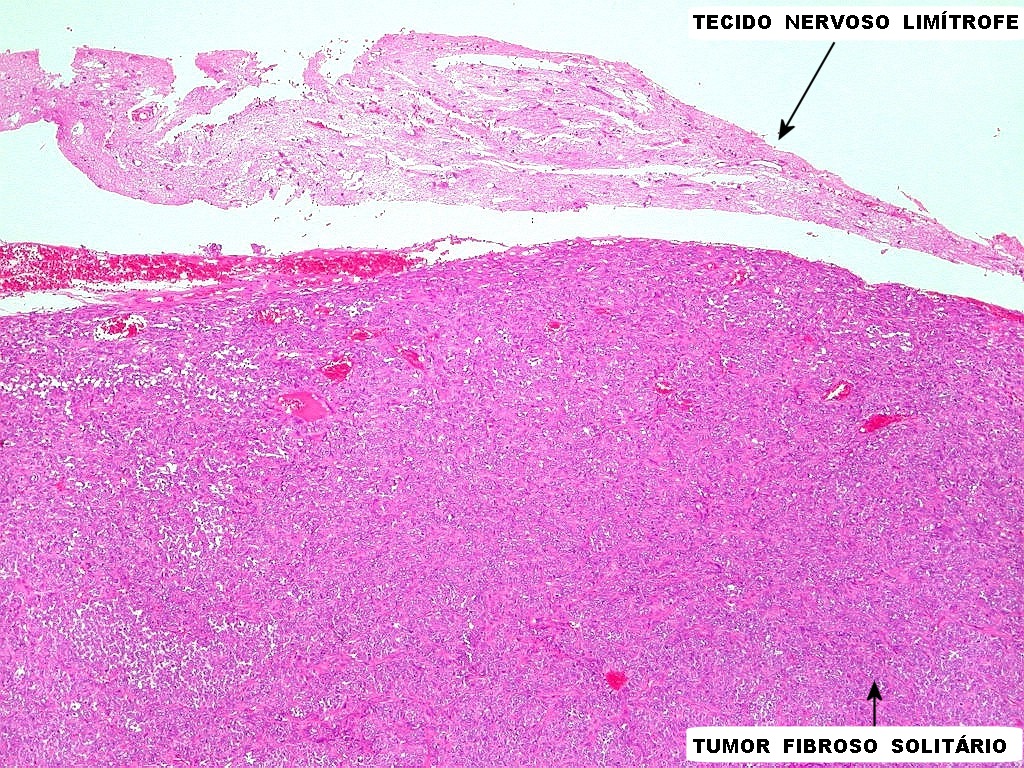 |
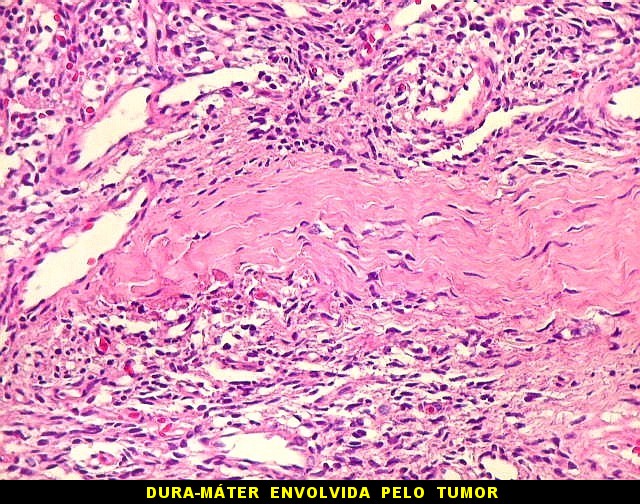 |
| Infiltração óssea. Observada em um tumor fibroso solitário em topografia epidural que atravessou o osso occipital e cresceu abaixo do couro cabeludo, sendo este o primeiro sintoma. | Necrose coagulativa. Áreas necróticas foram de observação rara tanto nos tumores fibrosos solitários como nos hemangiopericitomas. |
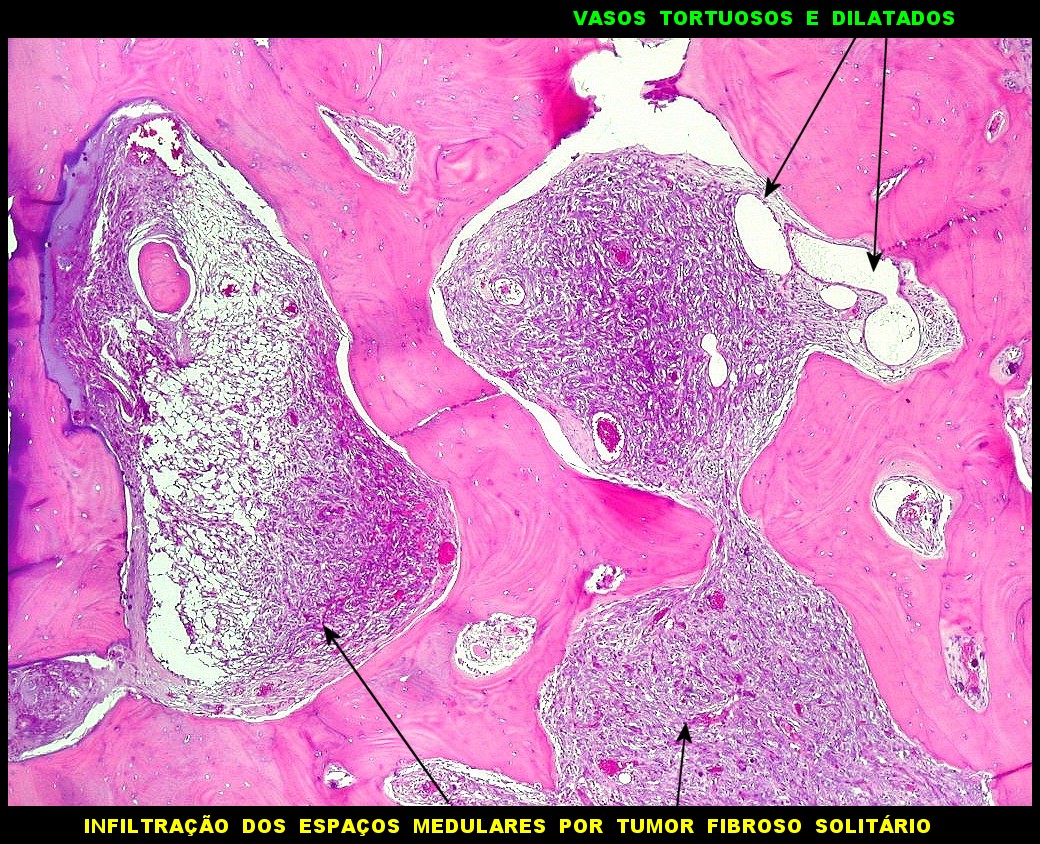 |
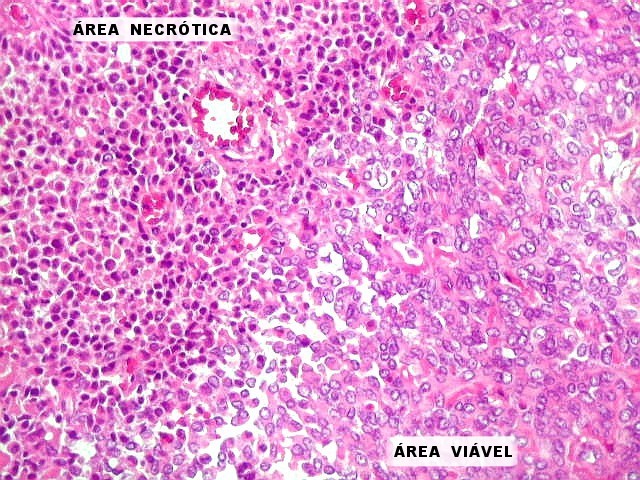 |
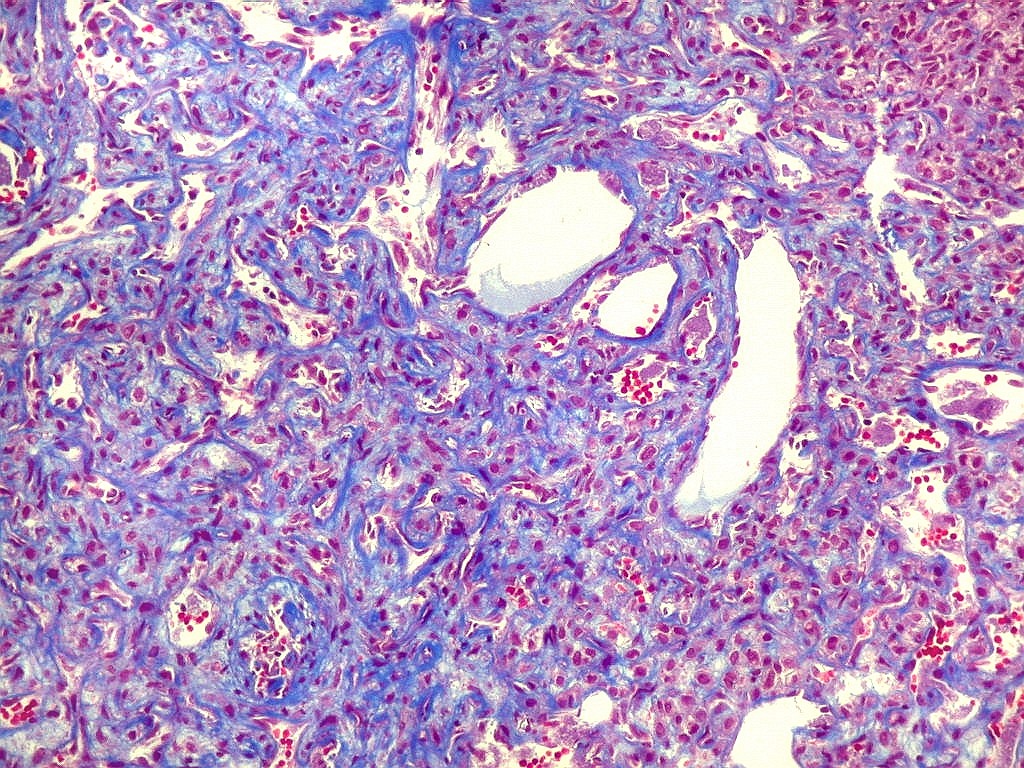
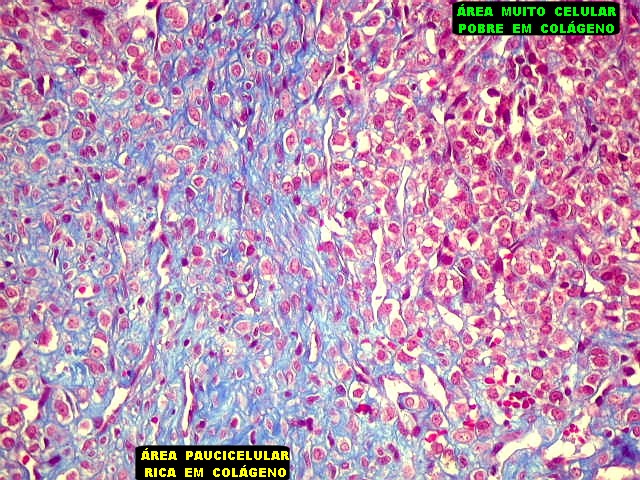
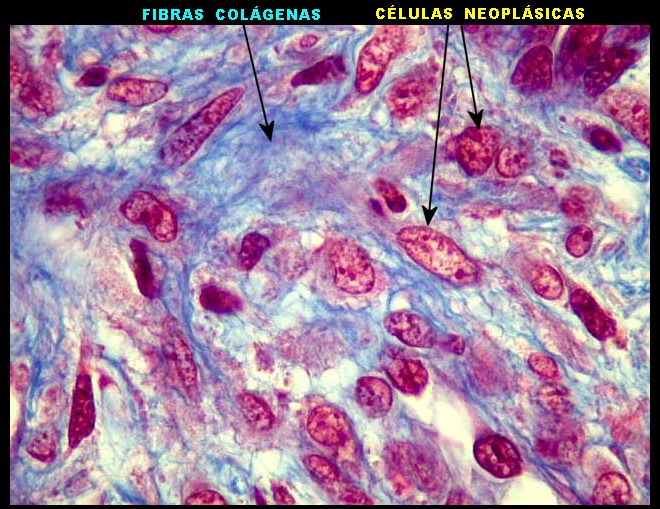
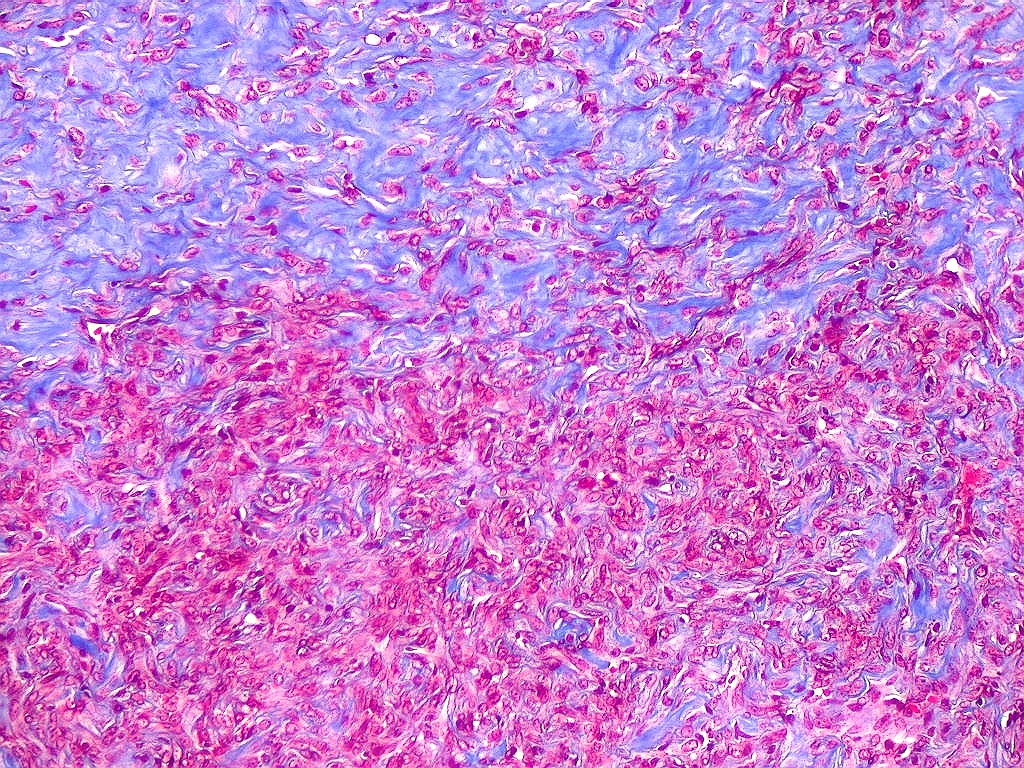
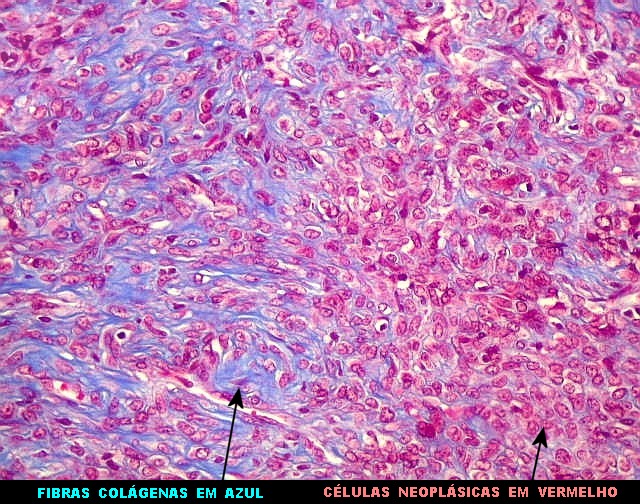
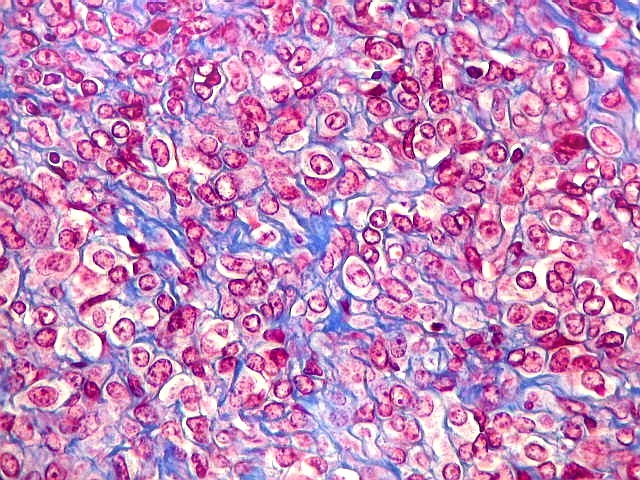
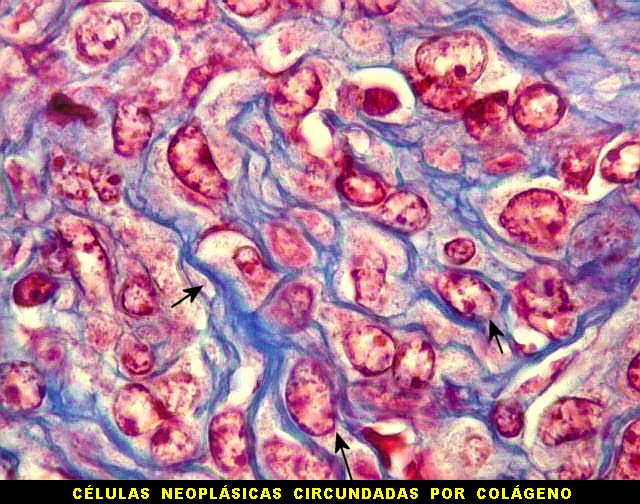
| Tricrômico de Masson. Como diferencia fibras colágenas (em azul) de elementos celulares (em vermelho), o tricrômico de Masson (para procedimento técnico, clique) é de grande valia no estudo dos tumores conjuntivos. No tumor fibroso solitário, demonstra a coexistência de áreas ricas e pobres em colágeno e, conversamente, pobres e ricas em células. As fibras colágenas (e as reticulínicas, abaixo) são produzidas pelas próprias células neoplásicas, que são fibroblastos CD34 positivos. | |
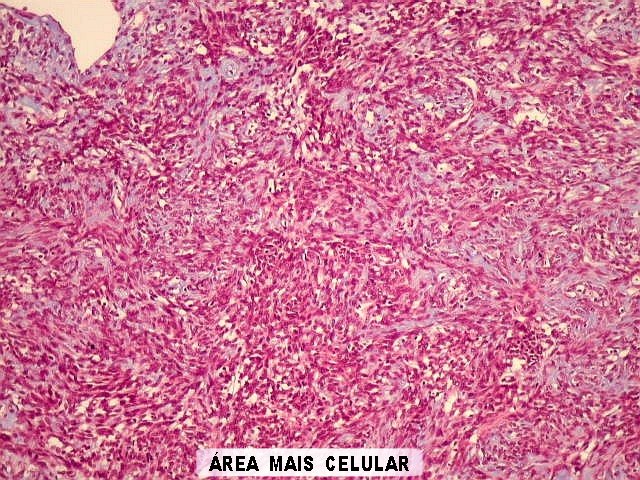 |
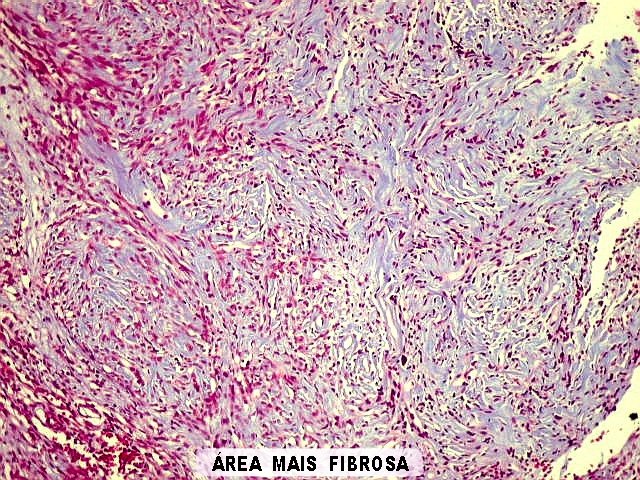 |
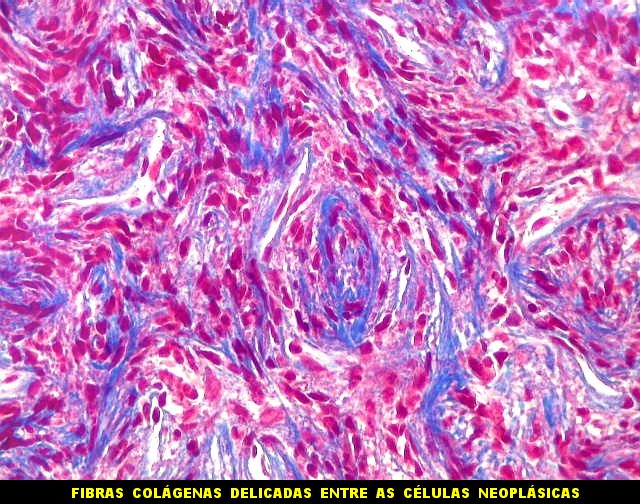 |
|
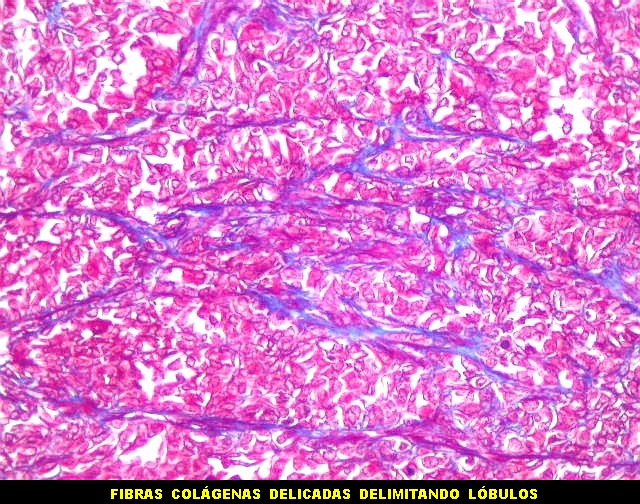 |
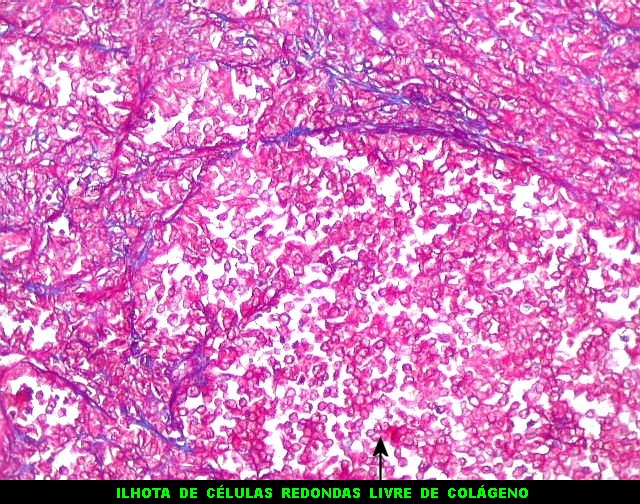 |
| Infiltração dural. A dura-máter, que se cora em azul, está envolvida pelo tumor, em vermelho. Notar a infiltração das células neoplásicas entre os feixes colágenos. | |
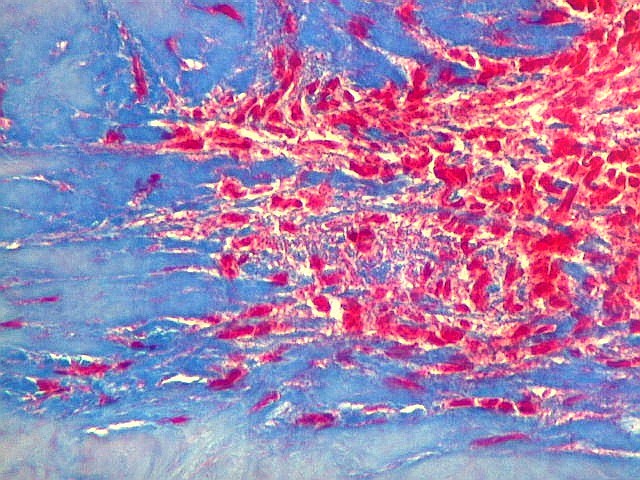 |
|
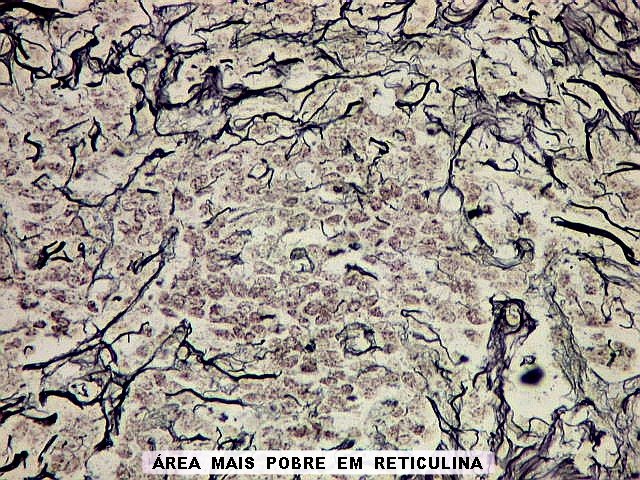
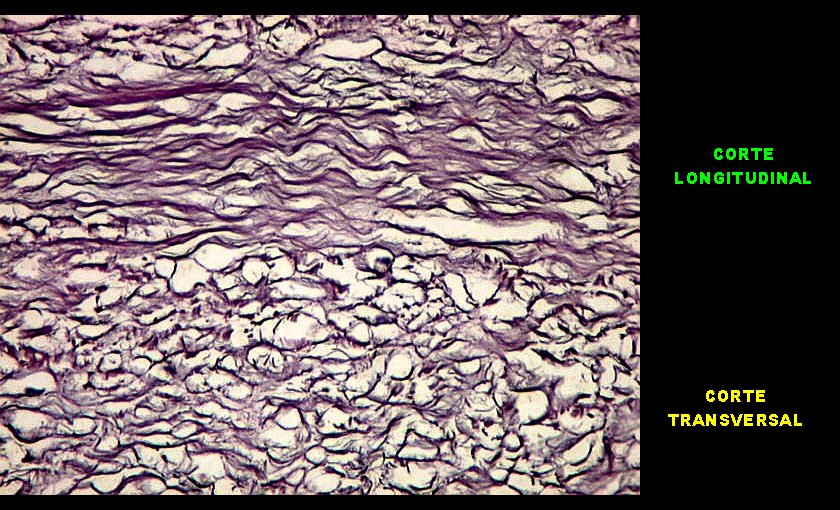
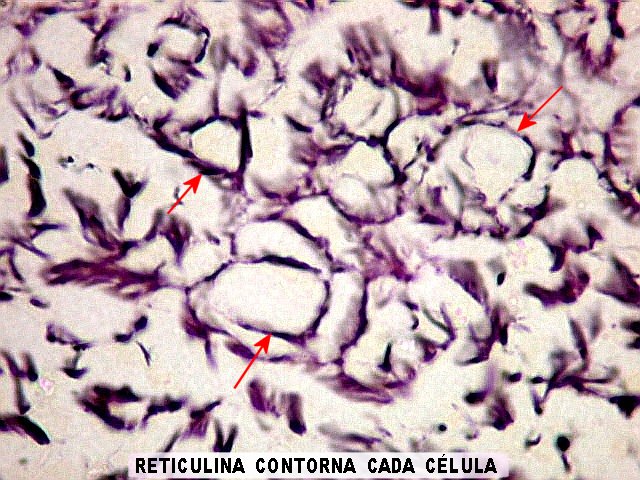
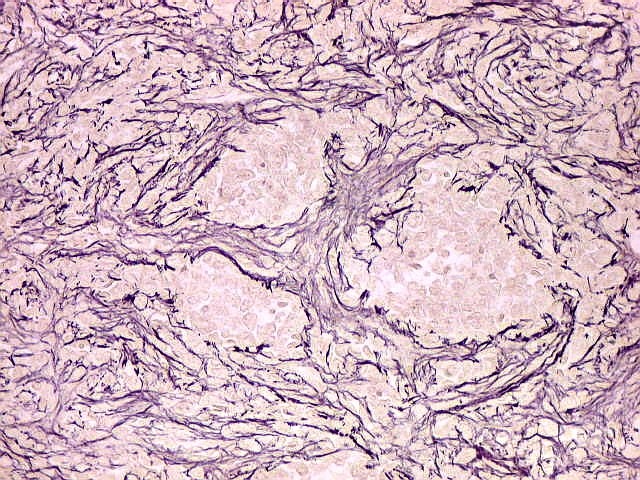
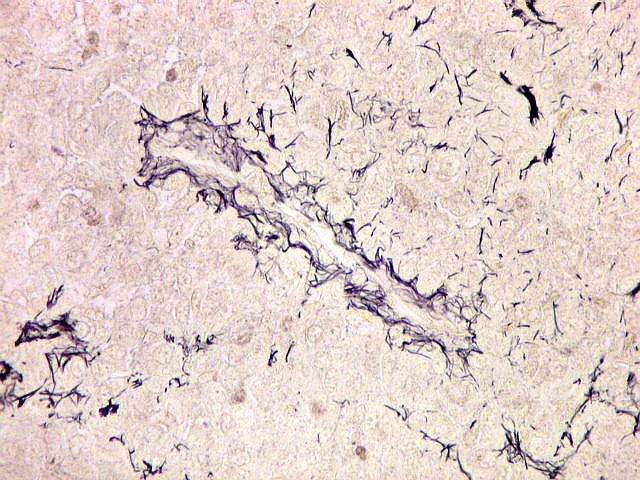
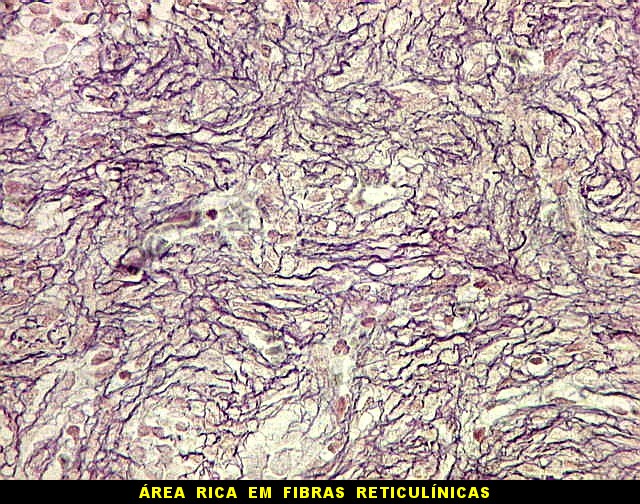
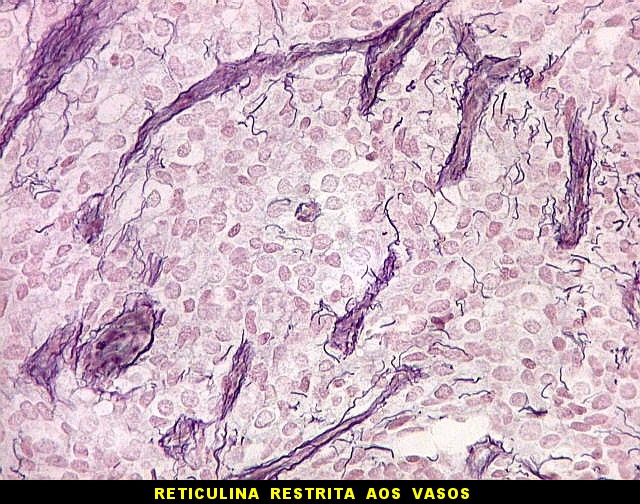
| Reticulina. As fibras reticulínicas são uma variedade de colágeno, também produzida pelas células neoplásicas. Para texto sobre estas fibras intersticiais do tecido conjuntivo, clique. No tumor fibroso solitário, as fibras reticulínicas são vistas em maior ou menor quantidade conforme a área, indo desde muito abundantes, envolvendo as células neoplásicas individualmente, a regiões onde são isoladas ou limitadas aos vasos. Aspectos semelhantes são observáveis no hemangiopericitoma. Para procedimento técnico da impregnação argêntica para reticulina, clique. | |
 |
|
 |
|
 |
|
 |
 |
 |
 |
|
|
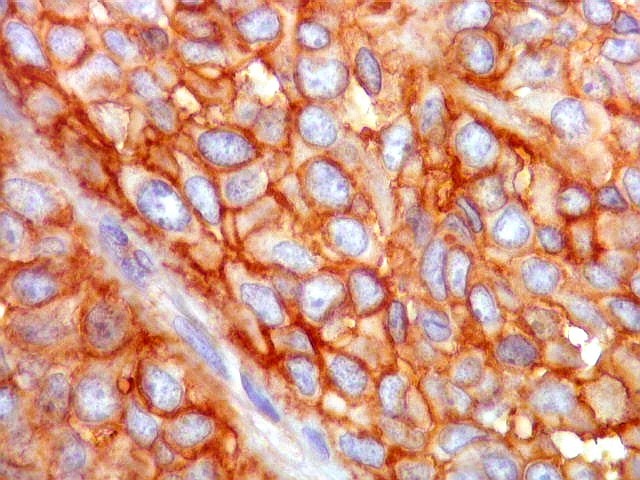
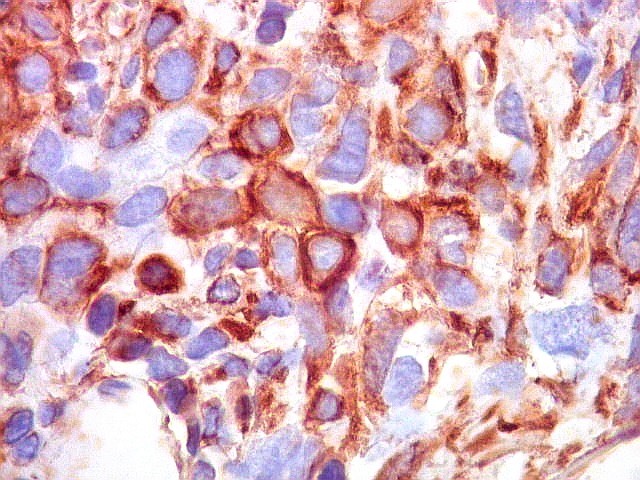
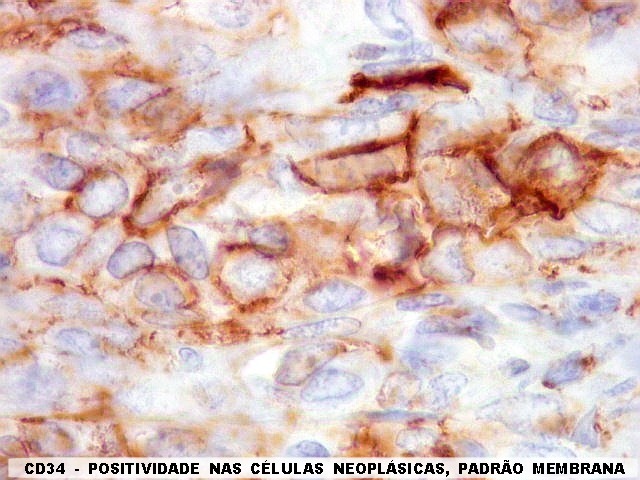
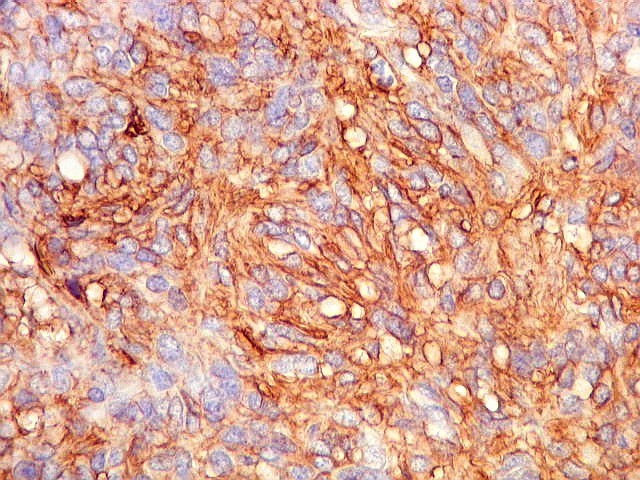
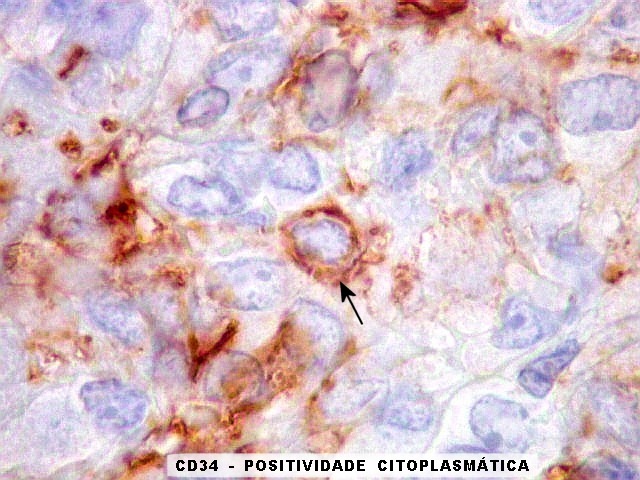
| CD34. Positividade para CD34 é um esteio do diagnóstico de tumor fibroso solitário. A positividade pode ser observada no citoplasma e/ou membrana celular. Em contraste, o hemangiopericitoma é descrito na literatura como negativo para CD34. Contudo, nos nossos casos, observamos áreas negativas para CD34 no TFS e positivas no HPC. Com a recente descoberta de que ambos tumores ostentam a mesma assinatura genética, estas diferenças tendem a ter menos importância. | |
 |
 |
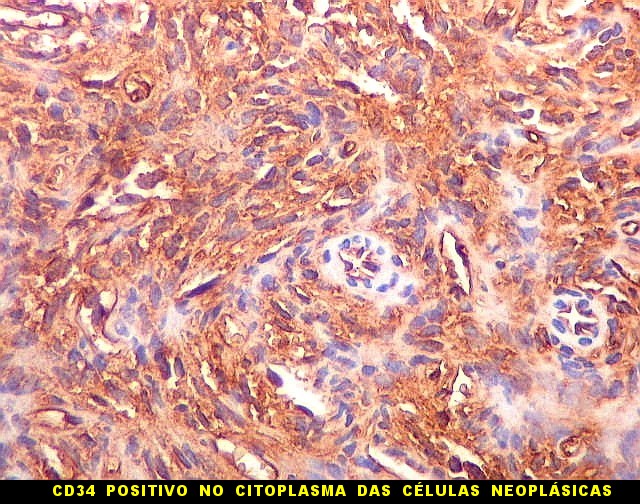 |
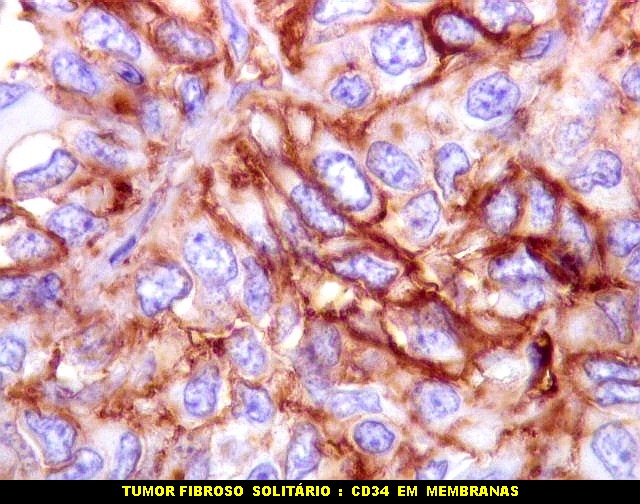 |
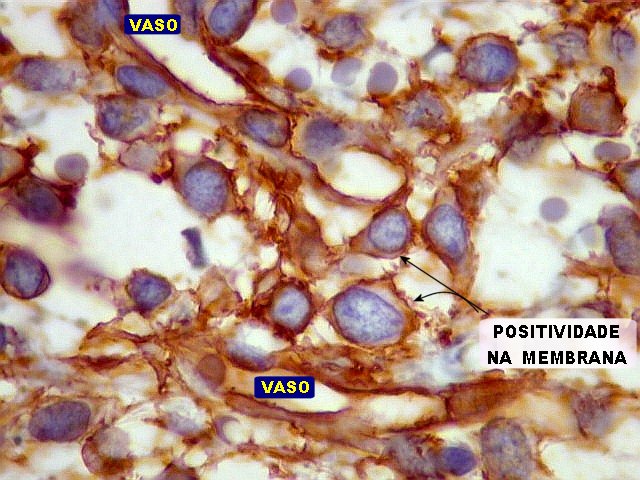 |
|
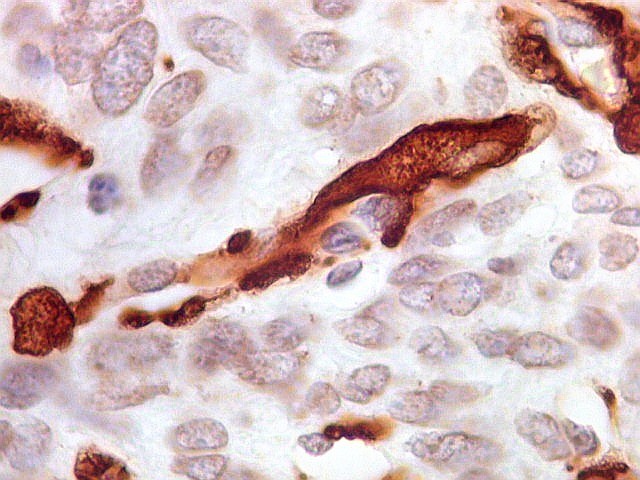
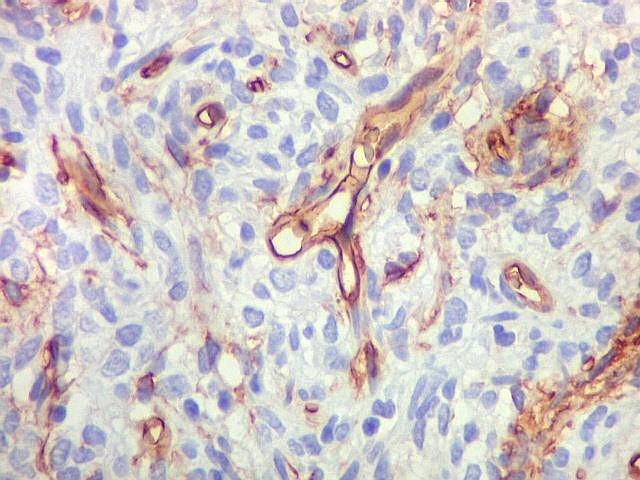
| CD34 positivo nos vasos. Positividade restrita ao endotélio vascular em áreas foi encontrada nos 3 exemplos de tumor fibroso solitário documentados abaixo. | |
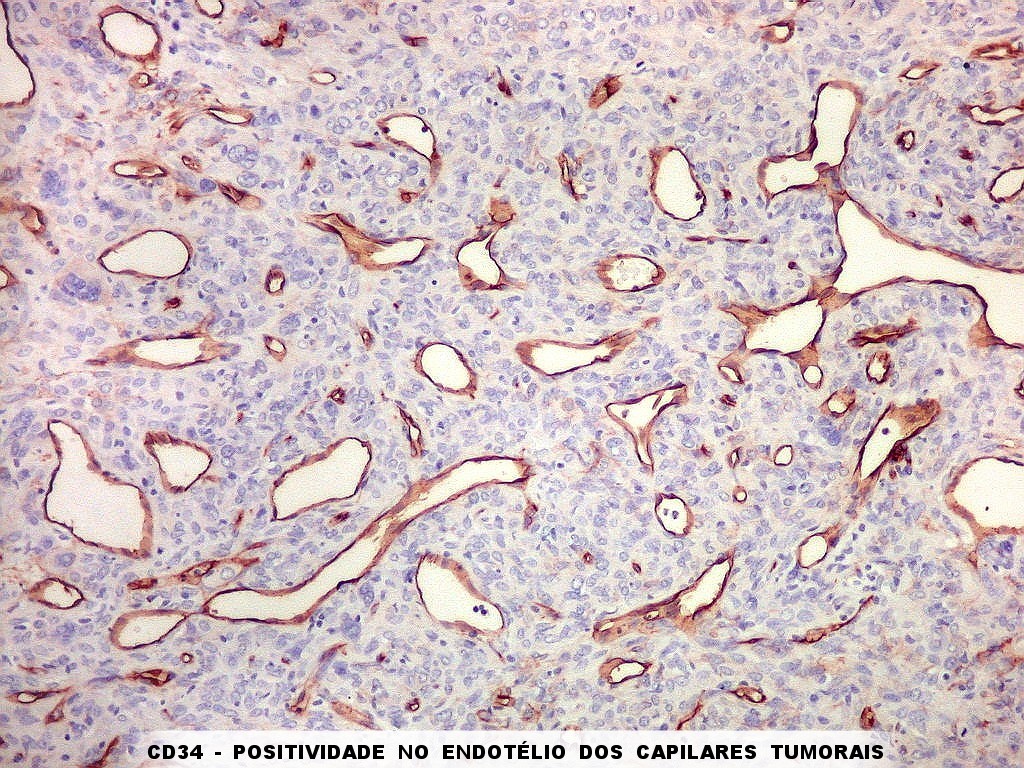 |
 |
 |
 |
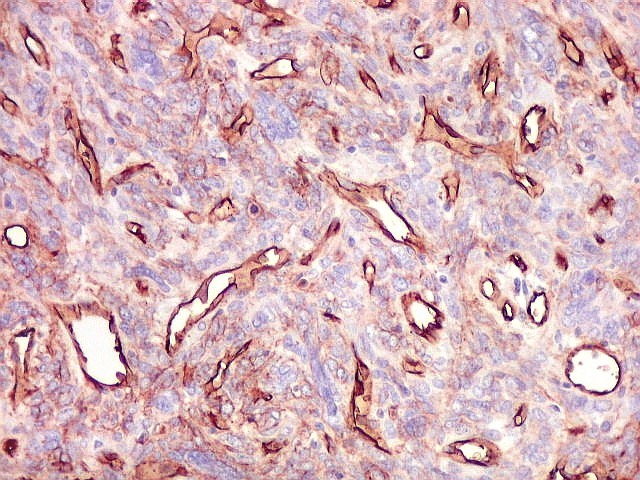
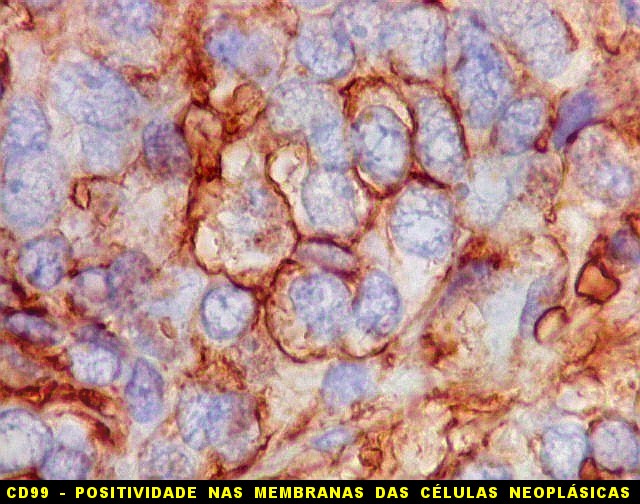
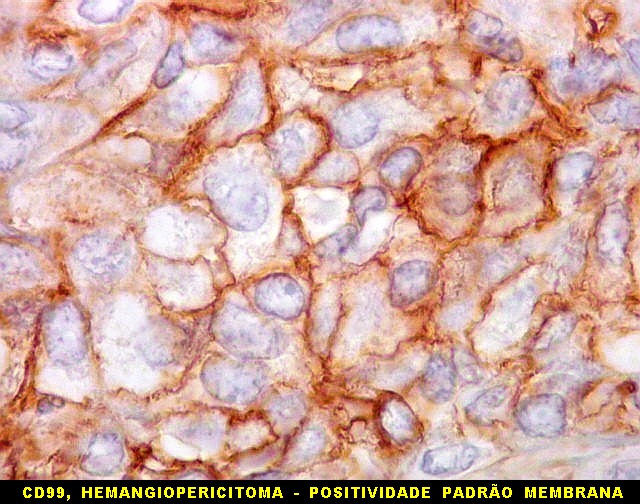
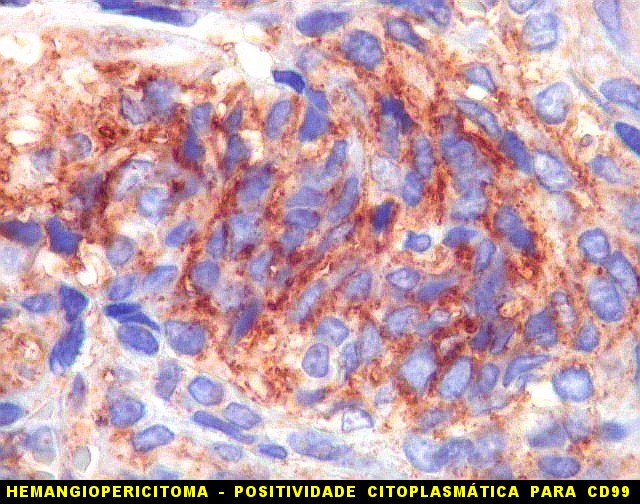
| CD99. CD99 (para breves textos, clique (1) (2) é positivo no citoplasma e/ou membrana plasmática das células neoplásicas. Como CD34 (acima) e BCL-2 (abaixo), é um dos critérios para o diagnóstico de tumor fibroso solitário e do hemangiopericitoma. Abaixo documentado em seis casos (clique nas figuras para seguir os links). | |
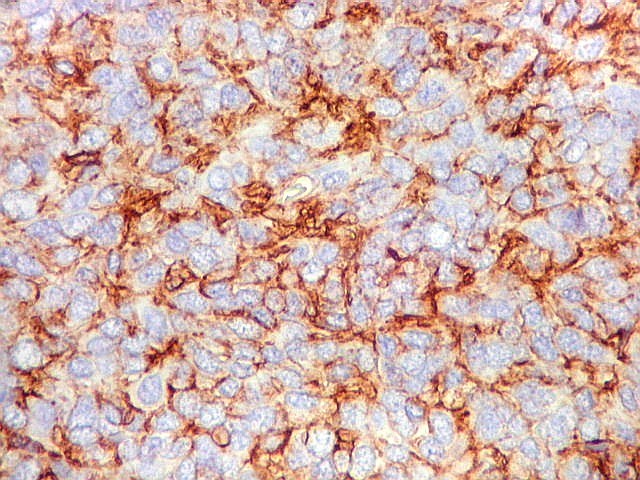 |
|
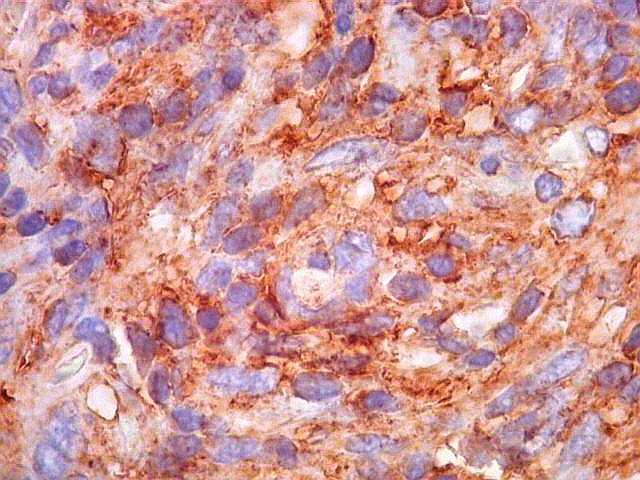 |
 |
 |
 |
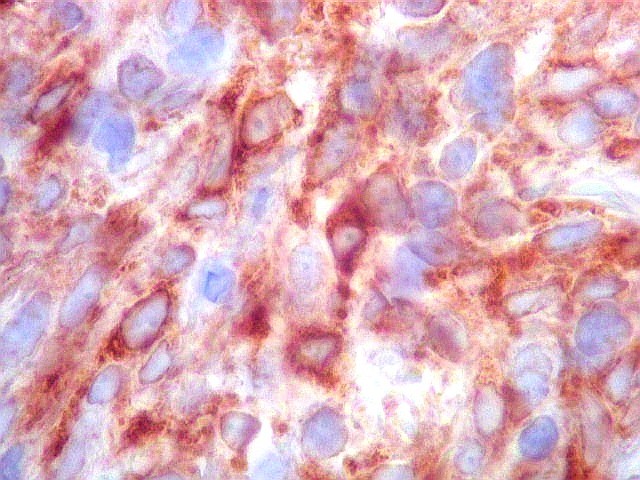
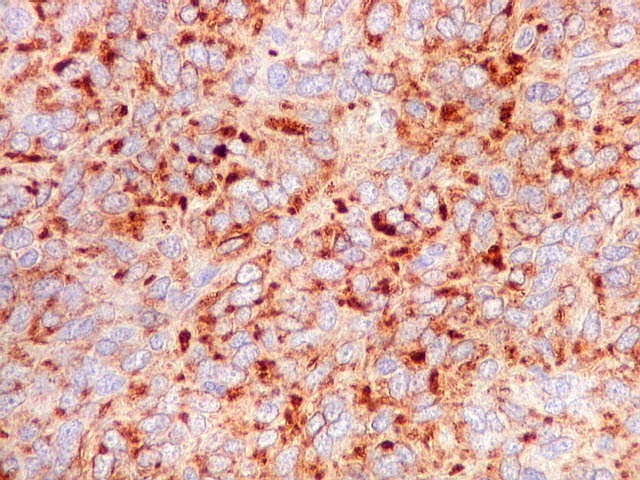
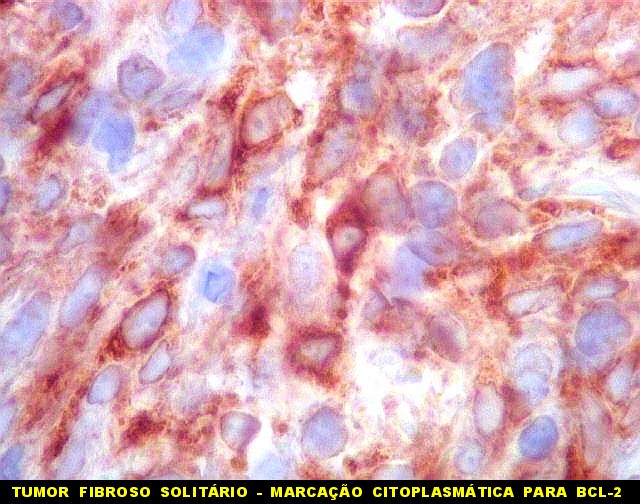
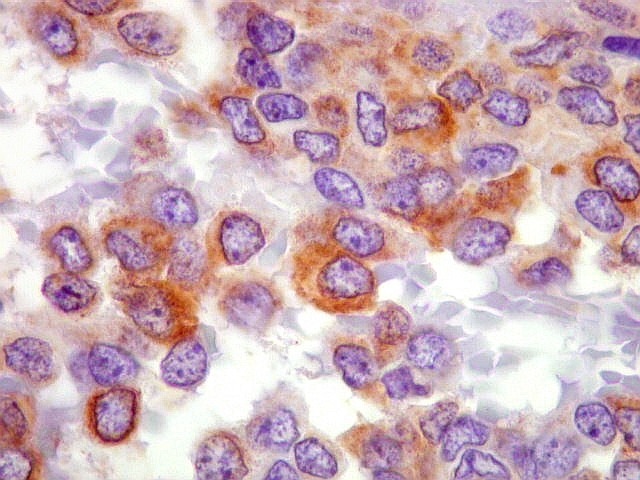
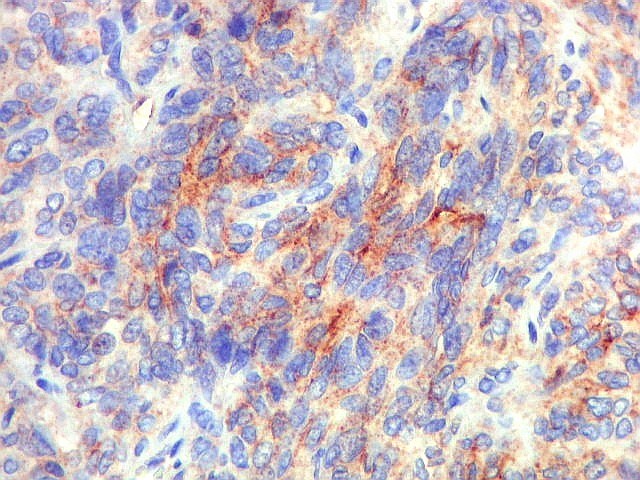
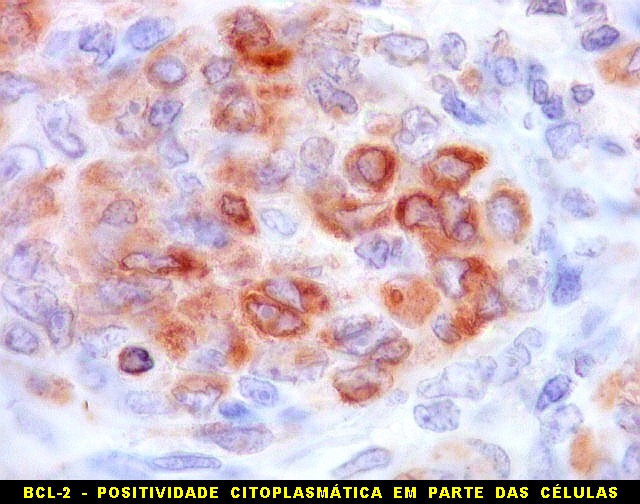
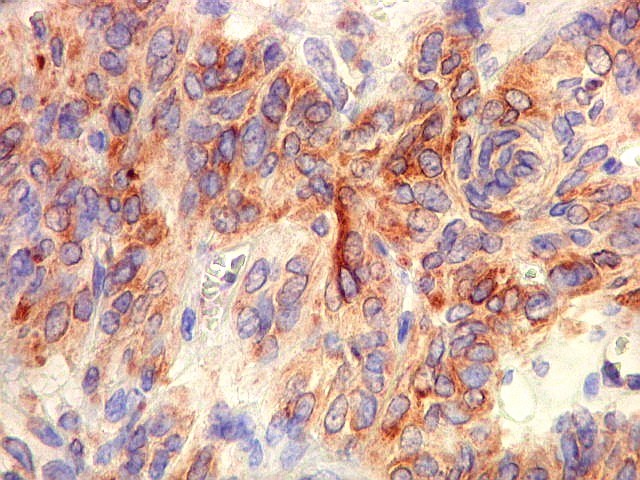
| BCL-2.
Positividade
citoplasmática para BCL-2 está entre os critérios
para tumor fibroso solitário e hemangiopericitoma.
Para breve texto, clique. Para breves textos sobre este marcador, clique (1) (2). Abaixo documentado em seis casos (clique nas figuras para seguir os links). |
|
 |
 |
 |
|
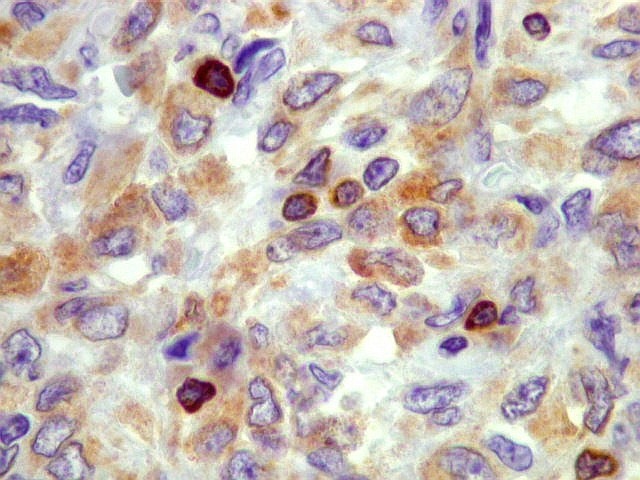
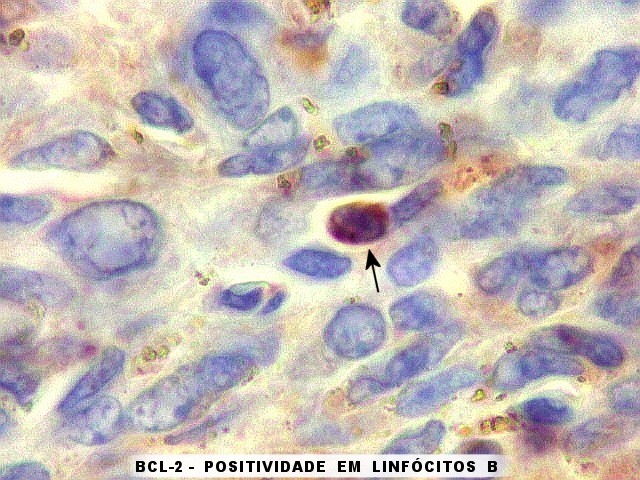
| BCL-2 em linfócitos. Células pequenas marcadas são provavelmente linfócitos B. | |
 |
|
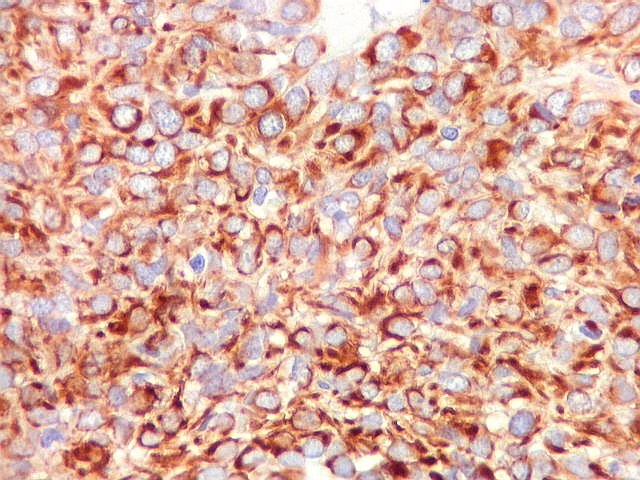
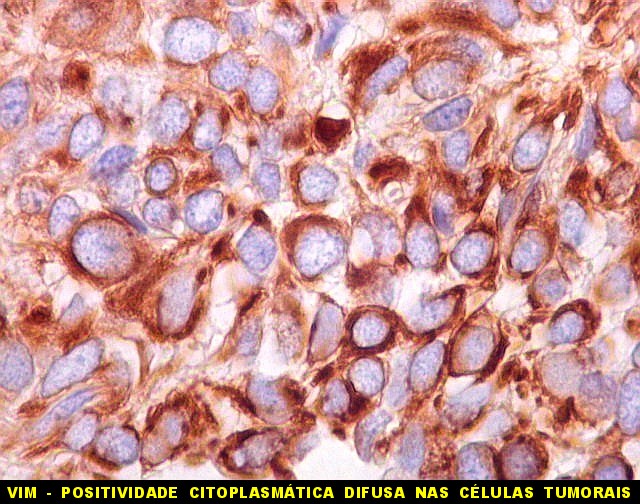
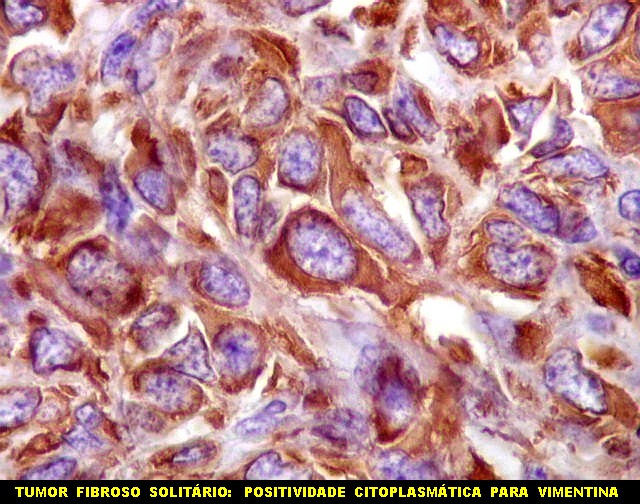
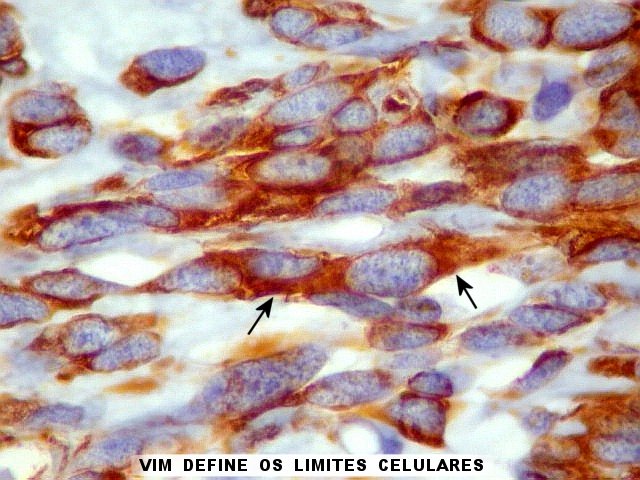
| VIM. Vimentina é um filamento intermediário ubiquitário, presente em células de várias linhagens, especialmente as de linhagem conjuntiva (para breves textos, clique (1)(2), é positiva com intensidade variável no citoplasma no tumor fibroso solitário e no hemangiopericitoma (resultado esperado). Vasos também são positivos. Abaixo, exemplos de 4 casos. | |
 |
 |
 |
 |
 |
|
| Outros. Além da positividade para CD34, CD99 e BCL-2, todas de valor diagnóstico para TFS, há marcação avulsa para antígenos epiteliais e musculares, pesquisados como parte de painéis para afastar diagnósticos diferenciais. Embora sem maior importância, registramos nossa experiência, que coincide com a da literatura. | |
| AE1AE3. Coquetel de anticorpos contra queratinas de alto e baixo peso molecular. Clique para texto. Aqui, positiva em um caso. | |
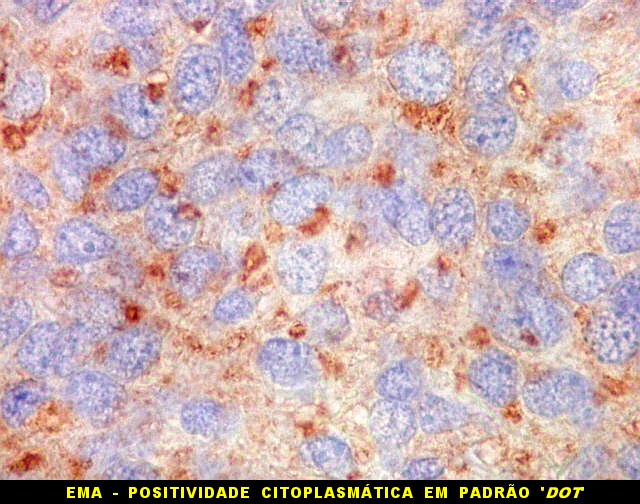
| EMA. Antígeno epitelial de membrana (clique para breve texto). É caracteristicamente positivo em meningiomas e negativo no TFS. Contudo, observamos marcação em 2 casos, um deles em padrão dot. | |
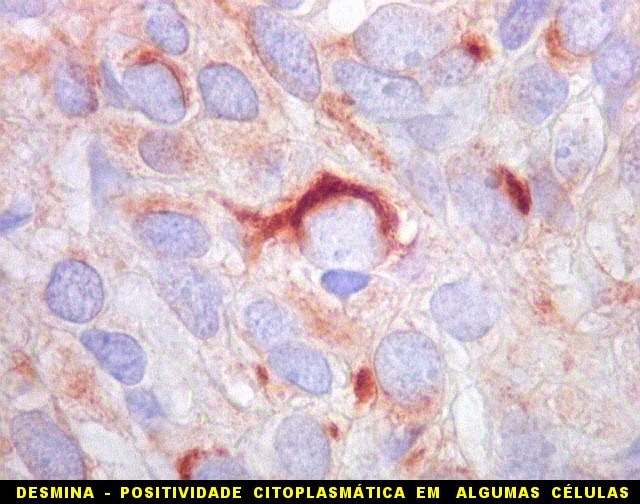
| EMA. | Desmina. Filamento intermediário próprio de músculo esquelético (para breve texto, clique). Aqui observado em um caso. |
 |
 |
| 1A4. Reconhece actina de músculo liso (para breve texto, clique). Aqui é positiva em vasos tumorais e em células tumorais isoladas. | |
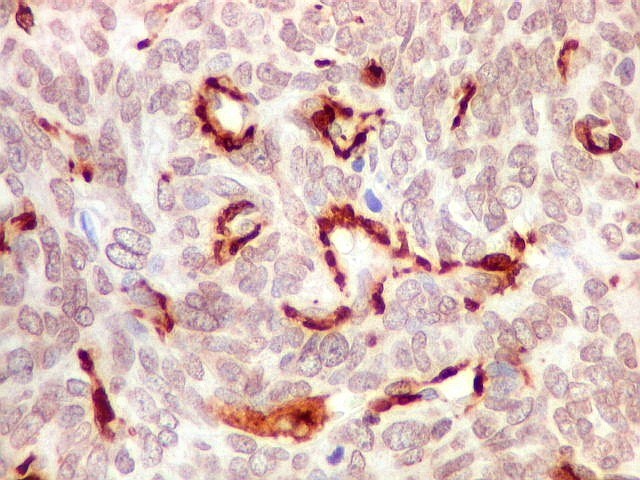 |
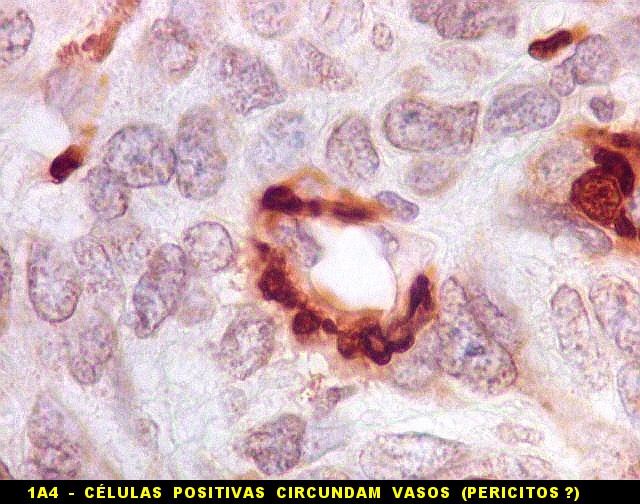 |
 |
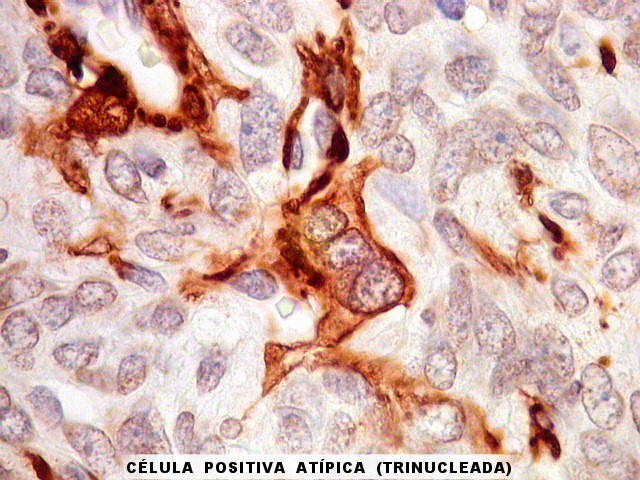 |
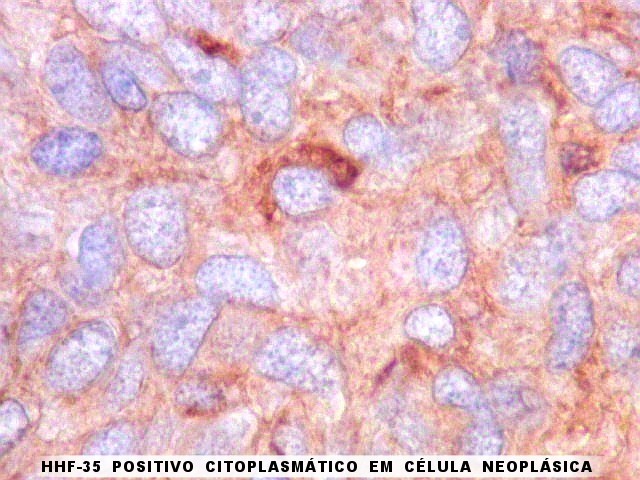
| HHF-35. Anticorpo contra actinas musculares (para breve texto, clique) foi positivo em vasos maiores e no citoplasma de células isoladas em um caso. | |
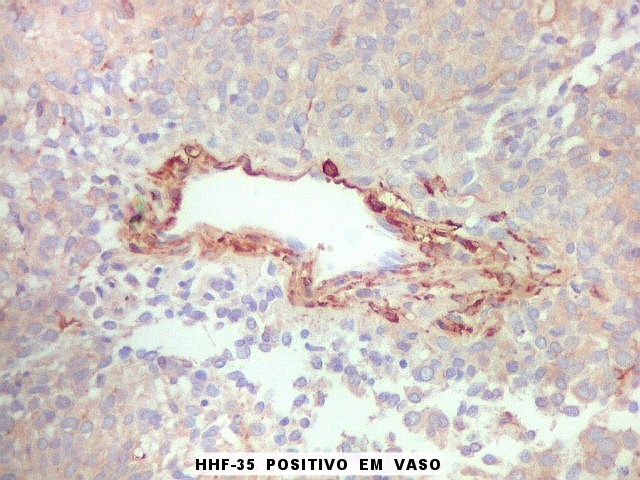 |
 |
| S-100. Positividade nuclear e citoplasmática em células isoladas distribuídas de forma mais ou menos uniforme por todo o tumor. Achado notado em 3 exemplos. Desconhecemos que células são e porque marcam. Sobre S-100. | |
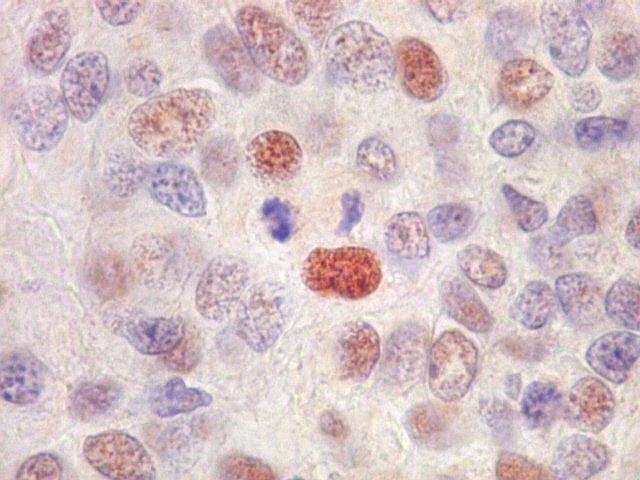
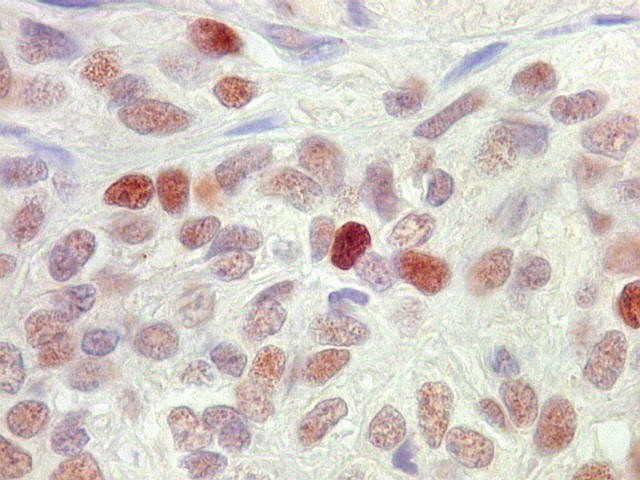
| p53. Positivo em intensidade e proporção variáveis nos núcleos das células neoplásicas. Significado nos escapa. | |
 |
 |
|
|
| Macroscopia. Exemplo de um caso. Tecido tumoral de cor rósea amarelada, em fragmentos irregulares e friáveis de várias dimensões. Em alguns, era possível reconhecer a superfície externa lobulada, recoberta por fina cápsula. Macroscopicamente, era indistinguível de um meningioma. O conjunto mediu 8 x 8 x 2,5 cm e pesou 60 g. |
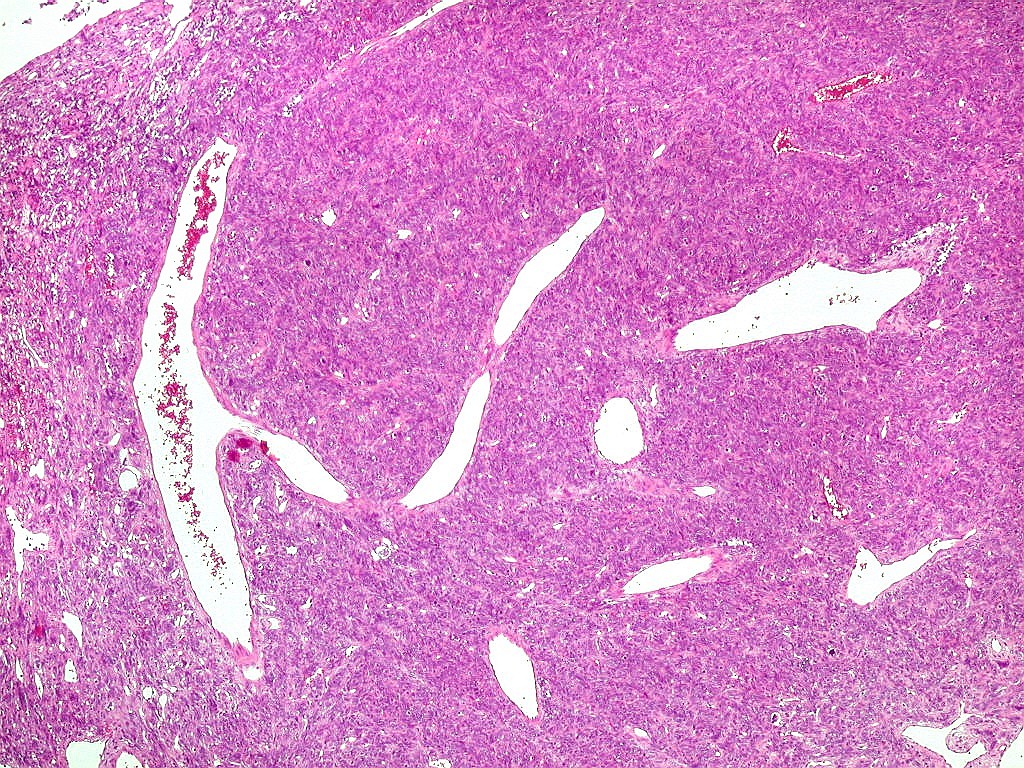
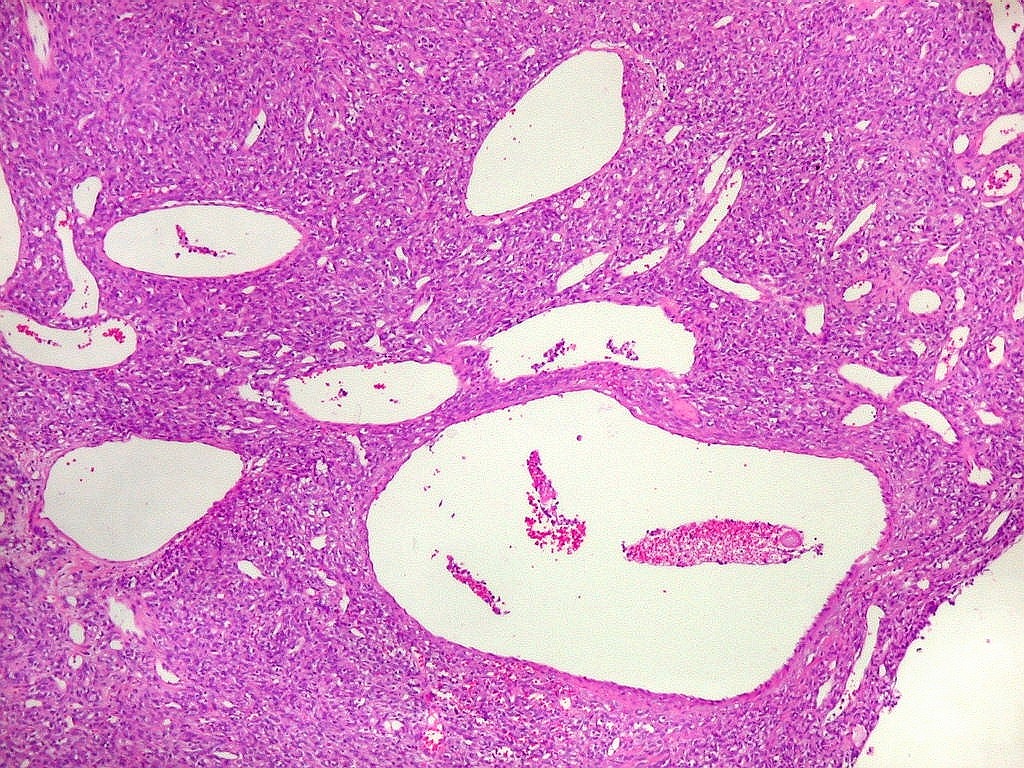
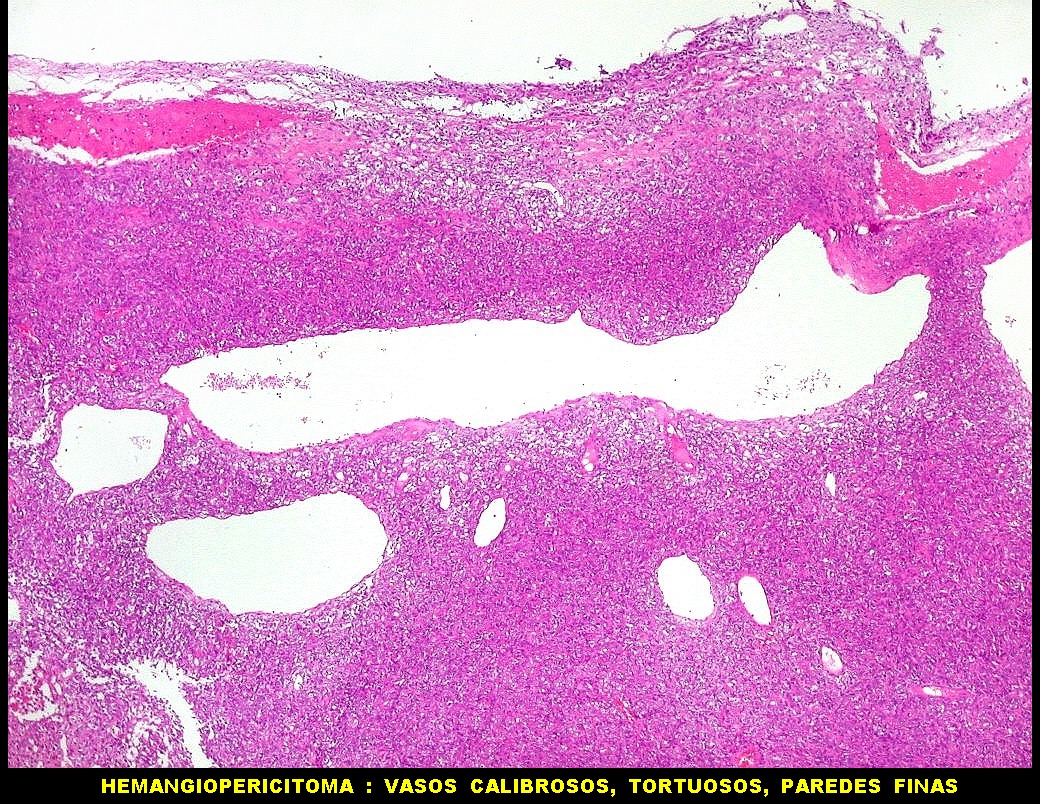
| Grandes
vasos.
O calibre dos vasos, que não sofreram colapso após a retirada do tumor, sugere alto fluxo, compatível com as imagens de flow void em ressonância magnética (clique para exemplos) e que prenuncia copioso sangramento cirúrgico. |
 |
 |
 |
 |
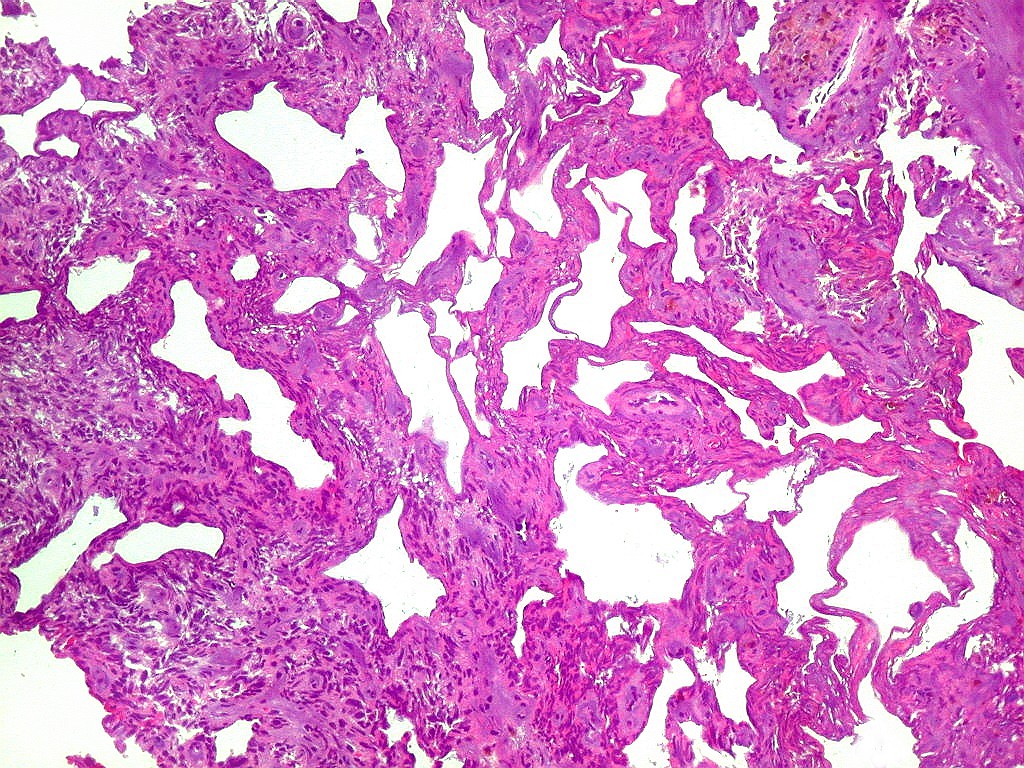
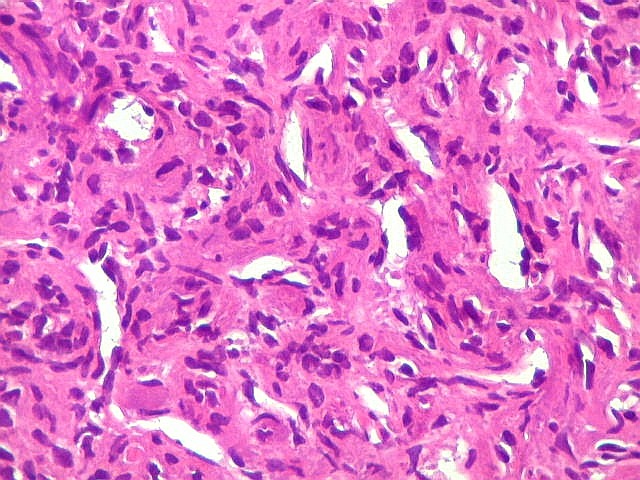
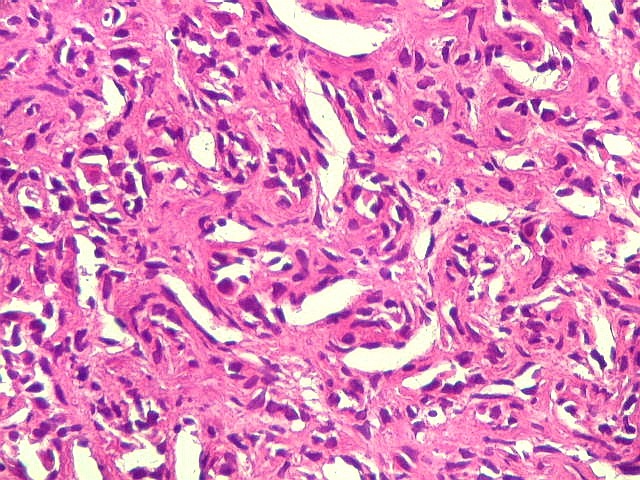
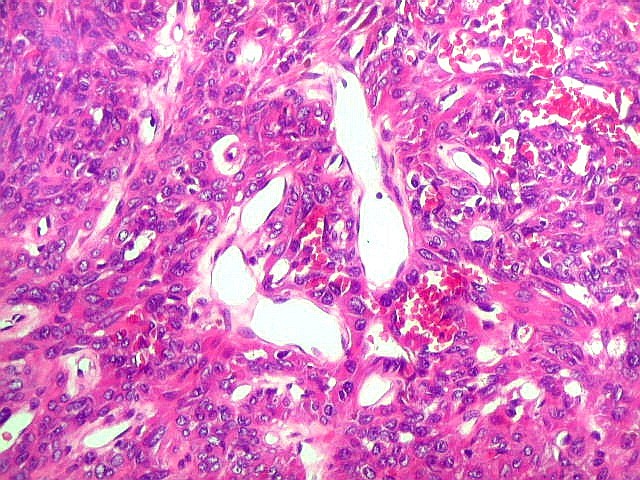
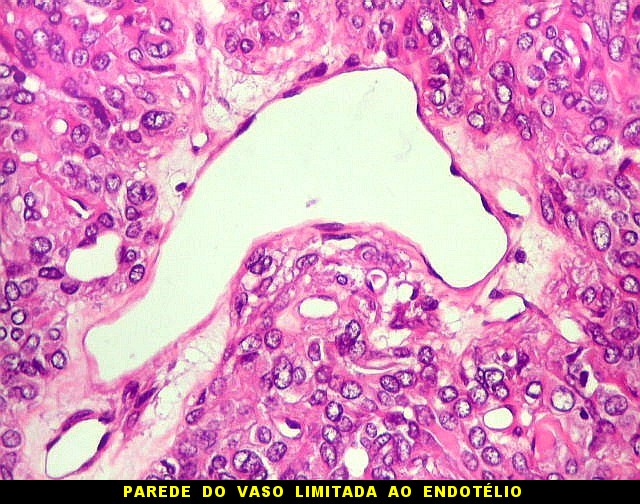
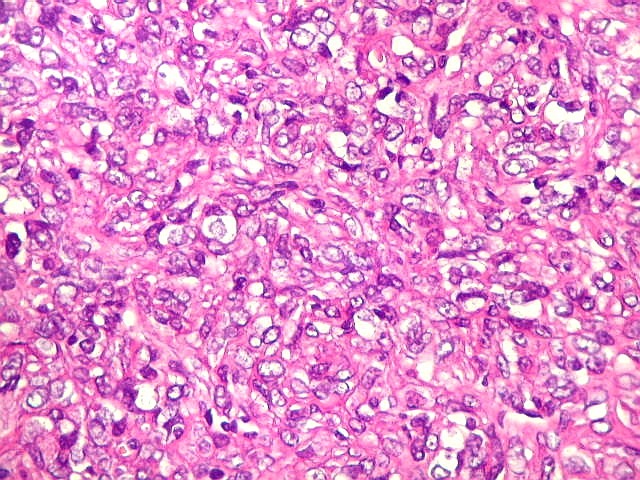
| Hemangiopericitoma - vasos menores. O tecido neoplásico tem vascularização impressionante, quase angiomatosa em áreas. Os pequenos vasos são constituídos apenas por uma camada de células endoteliais, sem parede própria. Sua luz é mantida pelo tecido em torno, mesmo quando não há hemácias na luz. A tortuosidade e irregularidade dos vasos maiores é também vista aqui. | |
 |
|
 |
 |
 |
 |
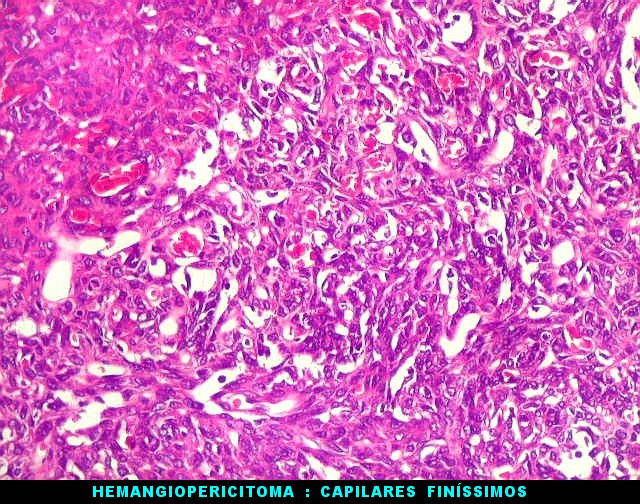 |
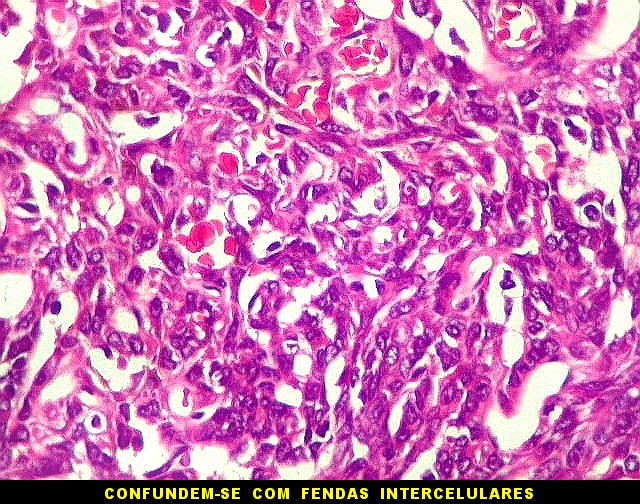 |
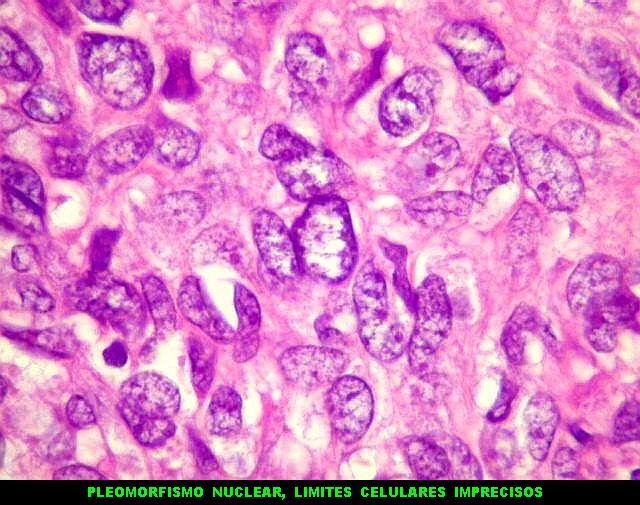
| Padrões arquiteturais. O predominante é de células fusiformes em feixes entrelaçados ou arranjo estoriforme. Ocasionalmente, as células assumem padrão epitelióide, e sua disposição perivascular cria um aspecto pseudopapilífero. O mesmo foi documentado no tumor fibroso solitário, enfatizando a semelhança (ou identidade) dos dois tumores. | |
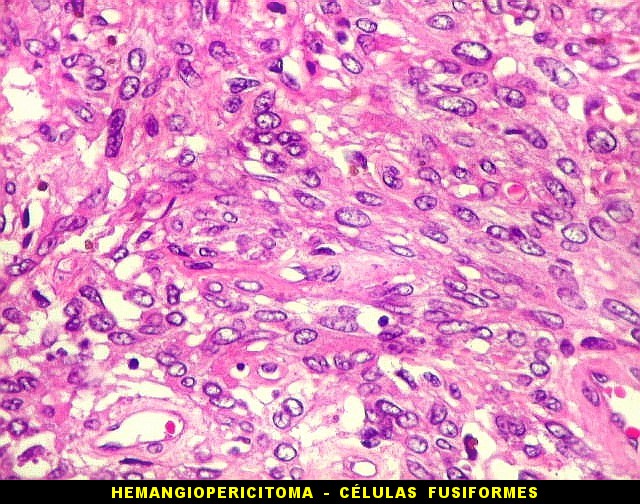 |
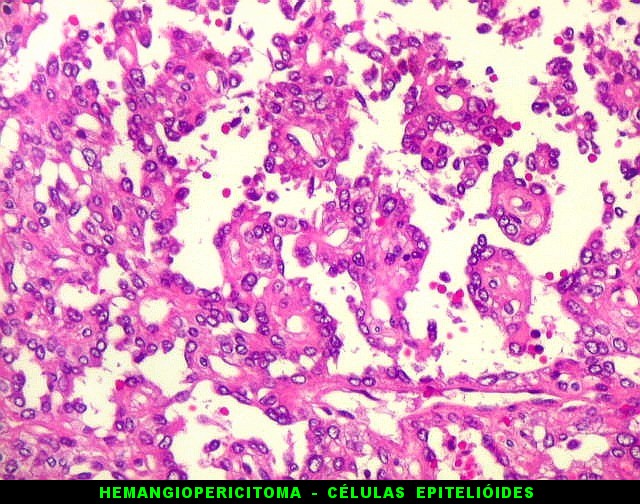 |
 |
|
 |
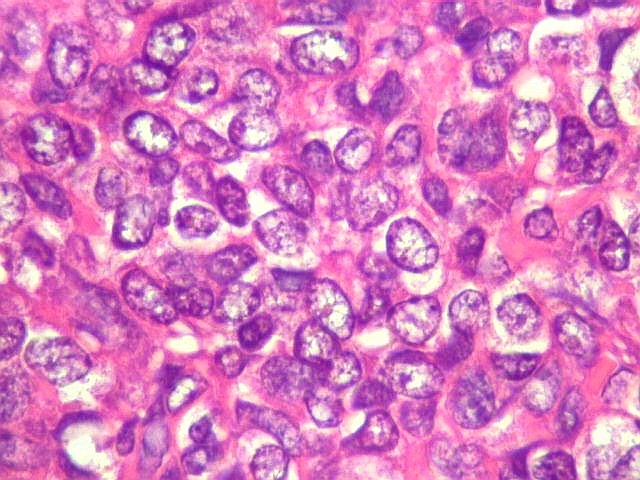 |
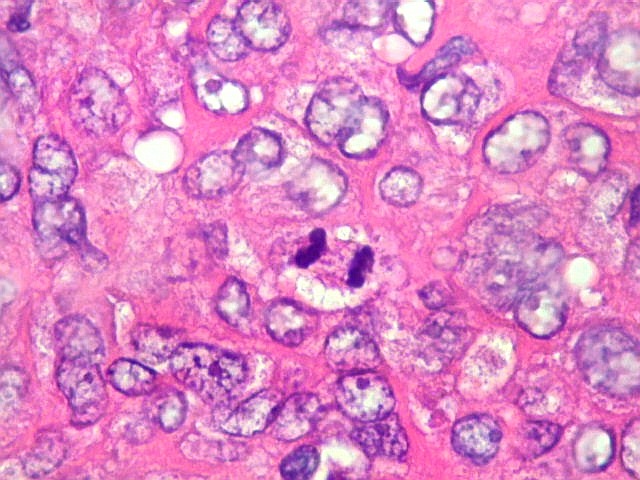
| Mitoses. Um número modesto de mitoses típicas é esperado no hemangiopericitoma. | |
 |
|
| Nucléolos. Nucléolos proeminentes sugerem síntese proteica ativa e maior atividade proliferativa, pois os nucléolos são o local no núcleo onde são montados os ribossomos. | Necrose. Áreas de necrose não são comuns nem extensas. |
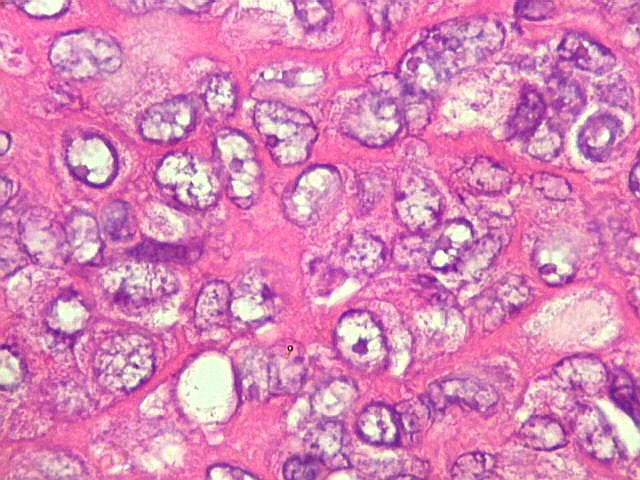 |
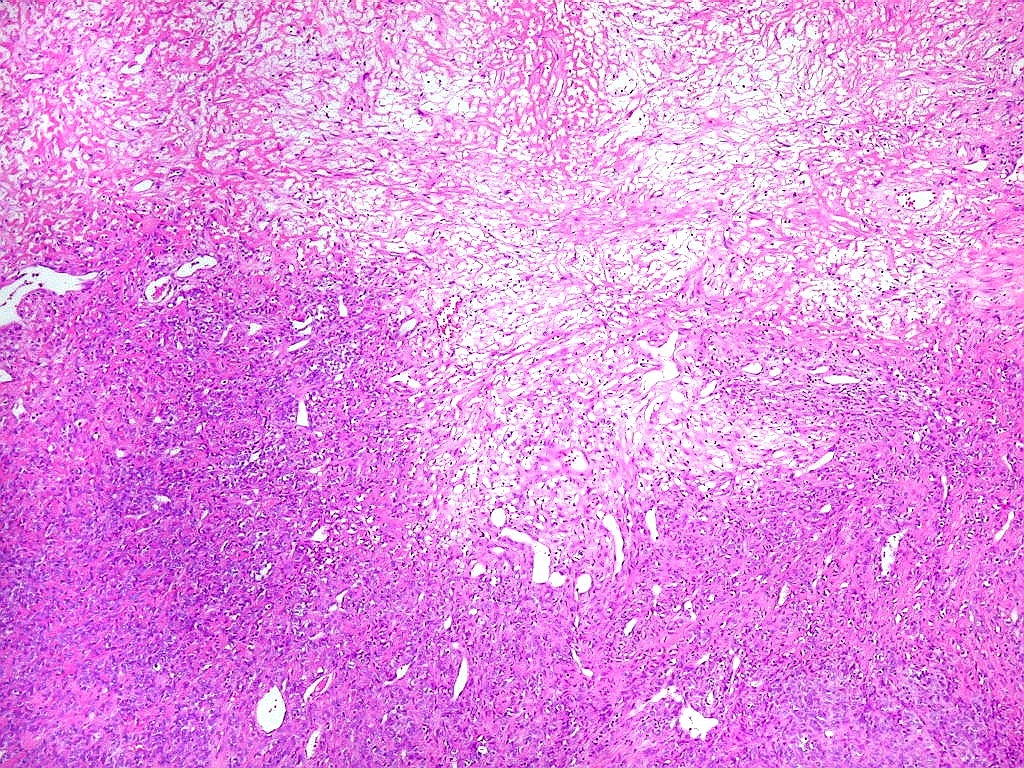 |
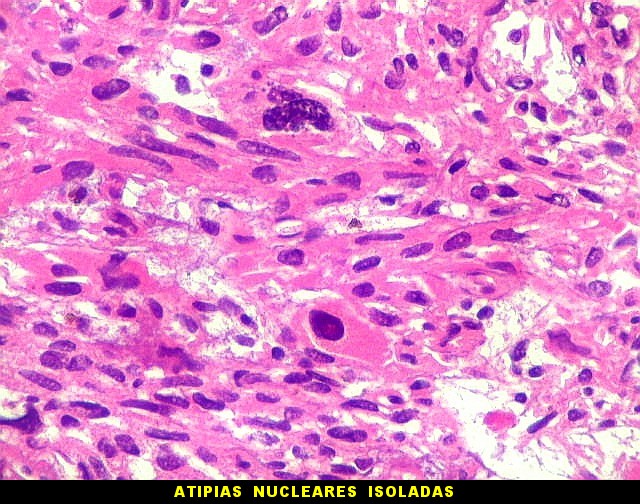 |
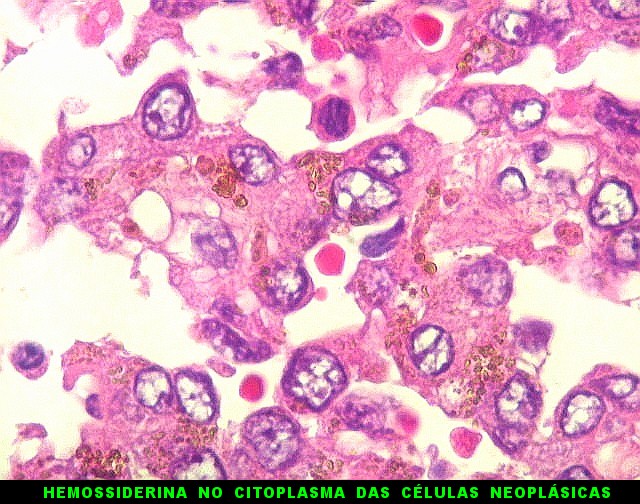 |
| Infiltração dural. Constatada em um caso de hemangiopericitoma e outro de TFS. | |
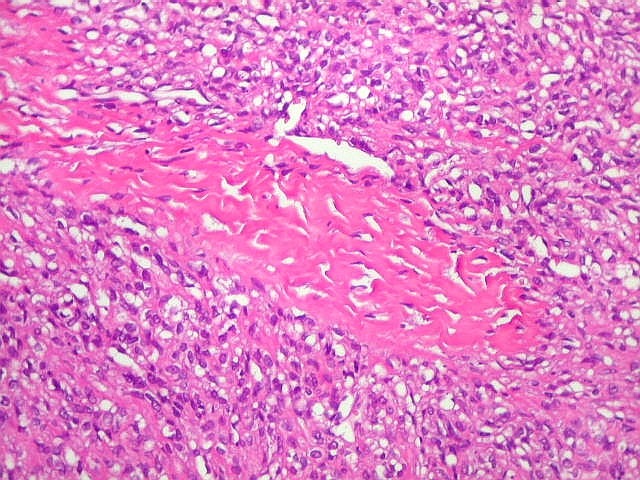 |
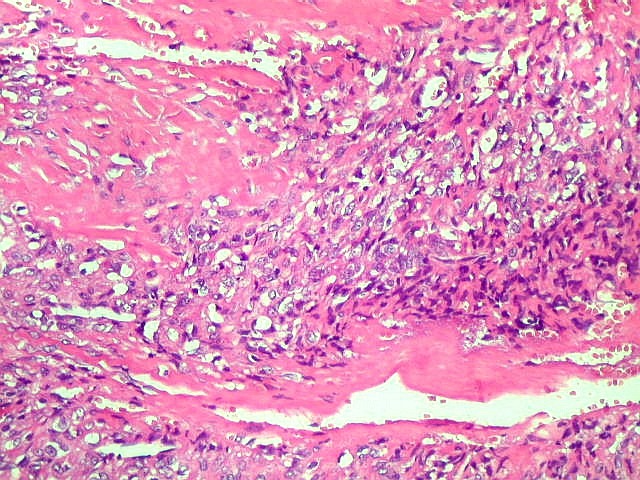 |
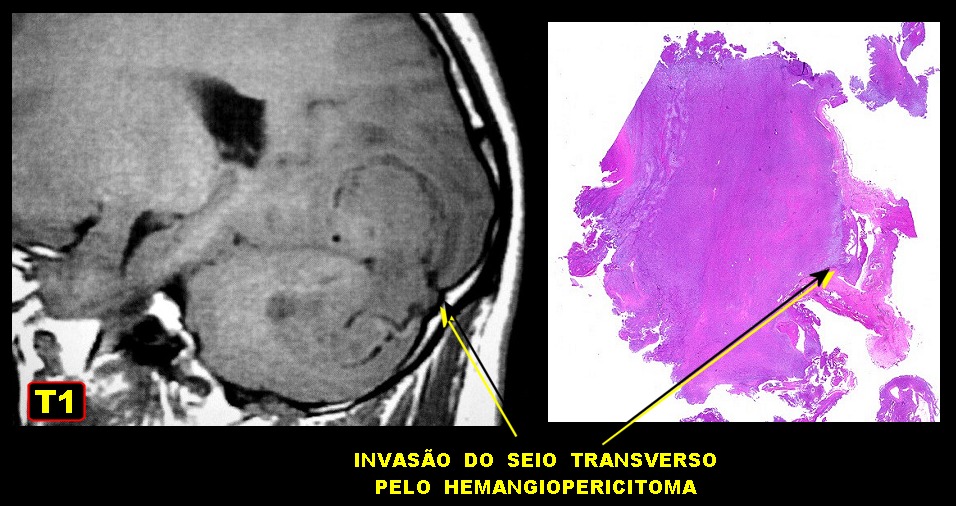 |
|
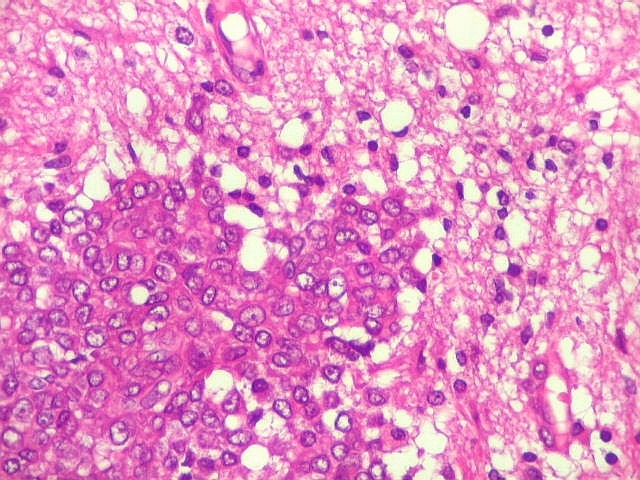
| Infiltração cerebral. O mesmo caso acima, que tinha infiltração dural, apresentava agressão direta ao tecido cerebral. | |
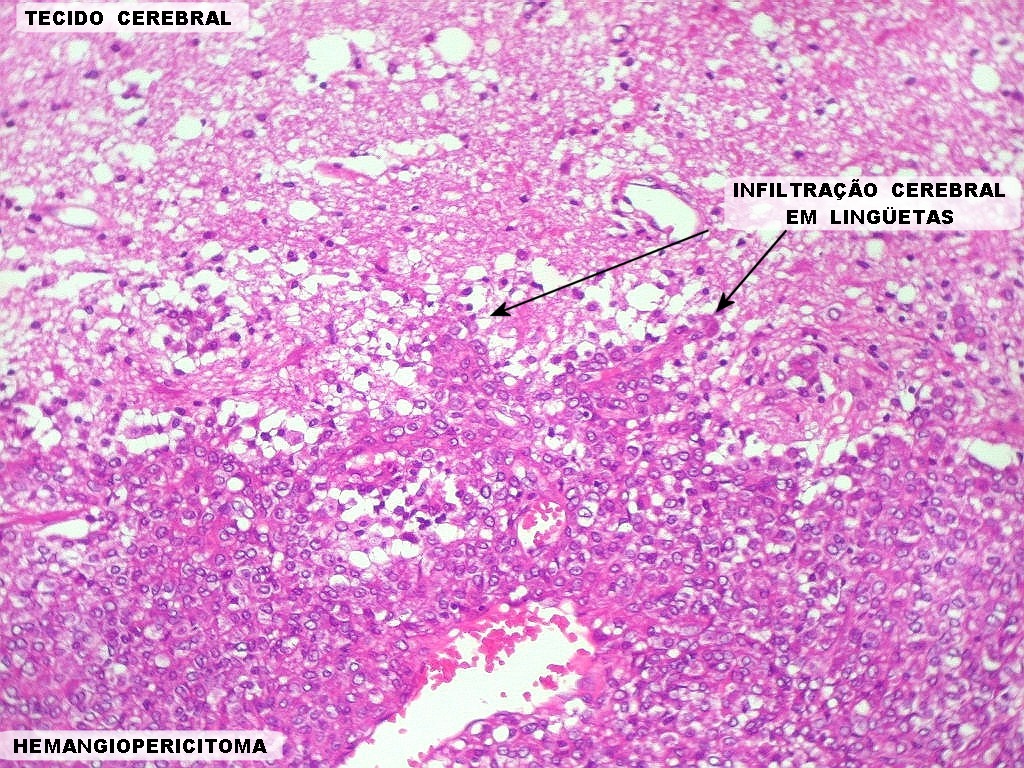 |
 |
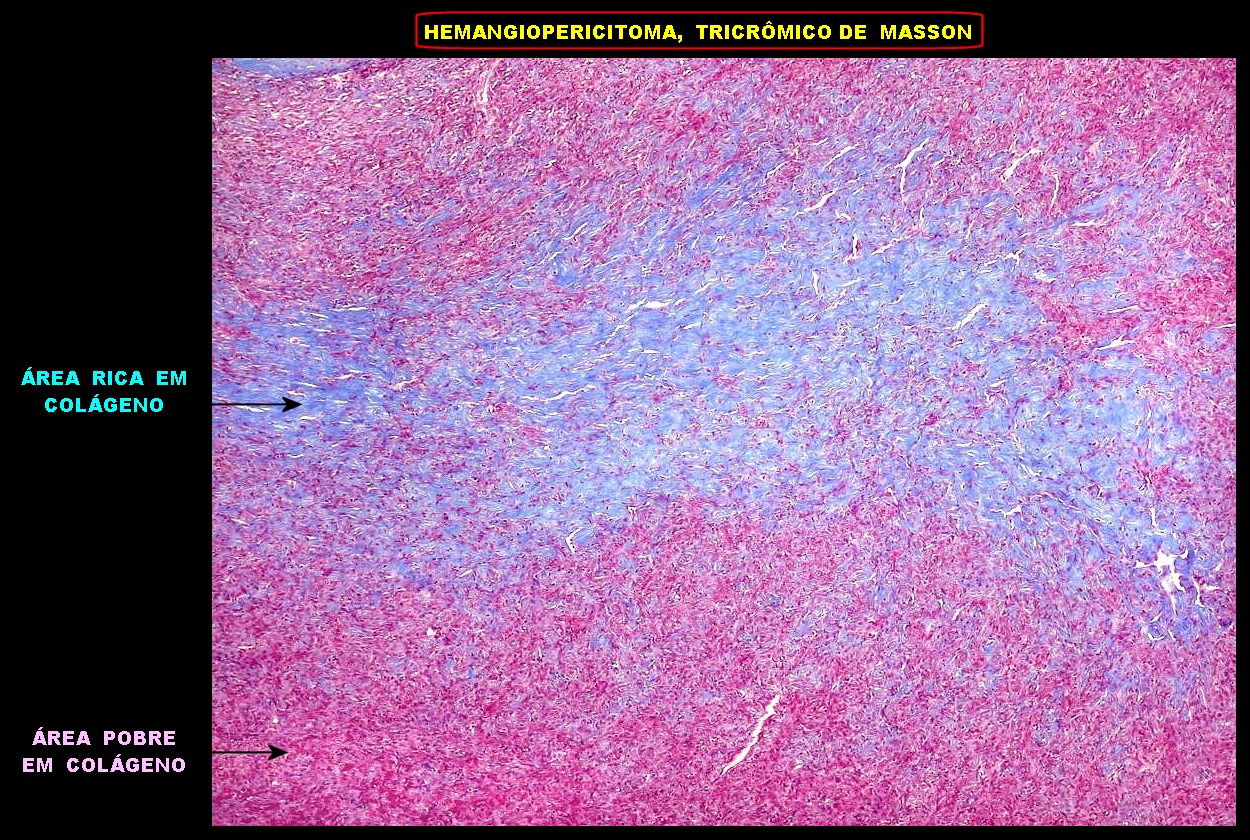
| Tricrômico
de Masson.
Como já comentado no TFS, o Masson realça áreas ricas e pobres em fibras colágenas, com resultados praticamente idênticos. |
 |
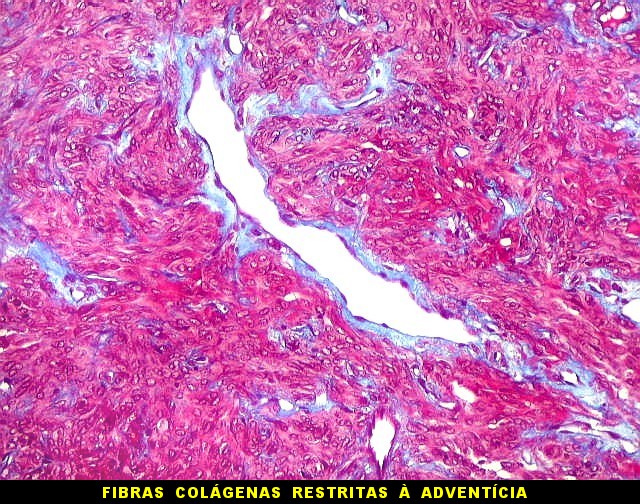
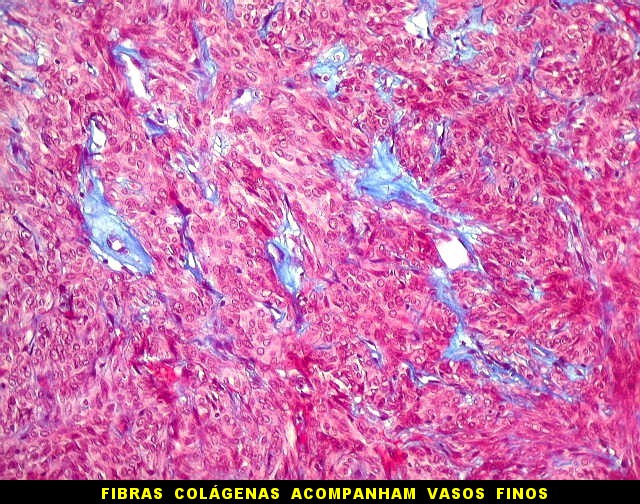
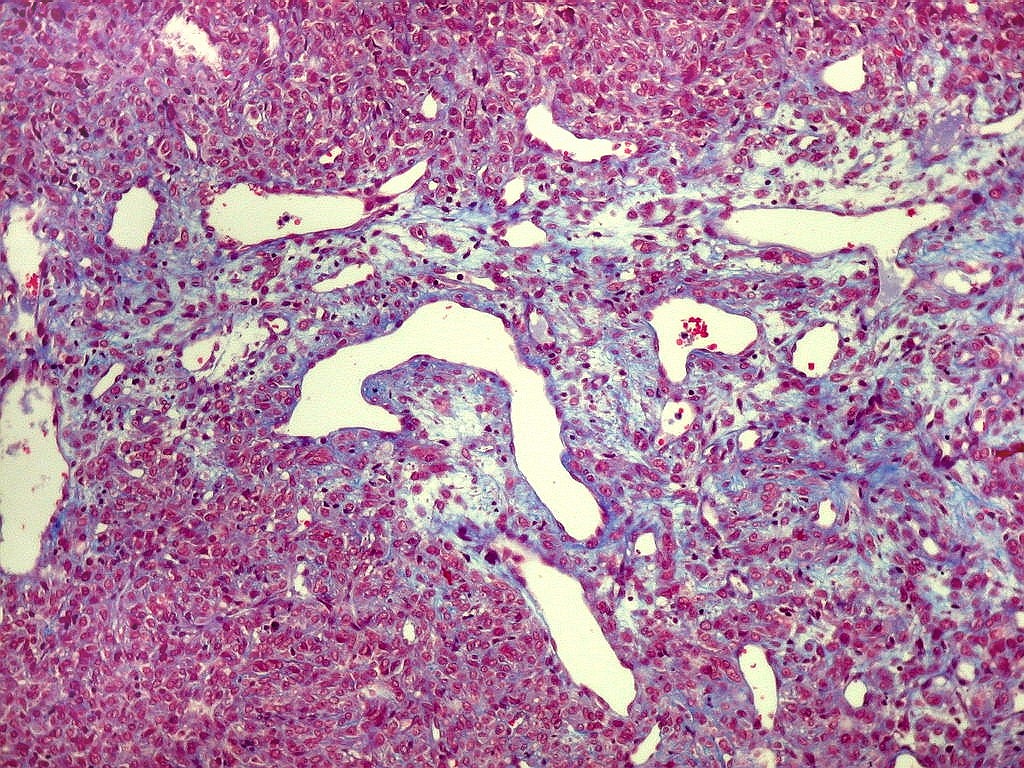
| Masson - vasos. O Masson, destacando as fibras colágenas, enfatiza a pobreza delas em torno dos vasos tumorais. Nos vasos maiores pode haver uma fina camada de adventícia. Nos menores, praticamente não há nem isso, e as células neoplásicas fazem contato com as células endoteliais. | |
 |
 |
 |
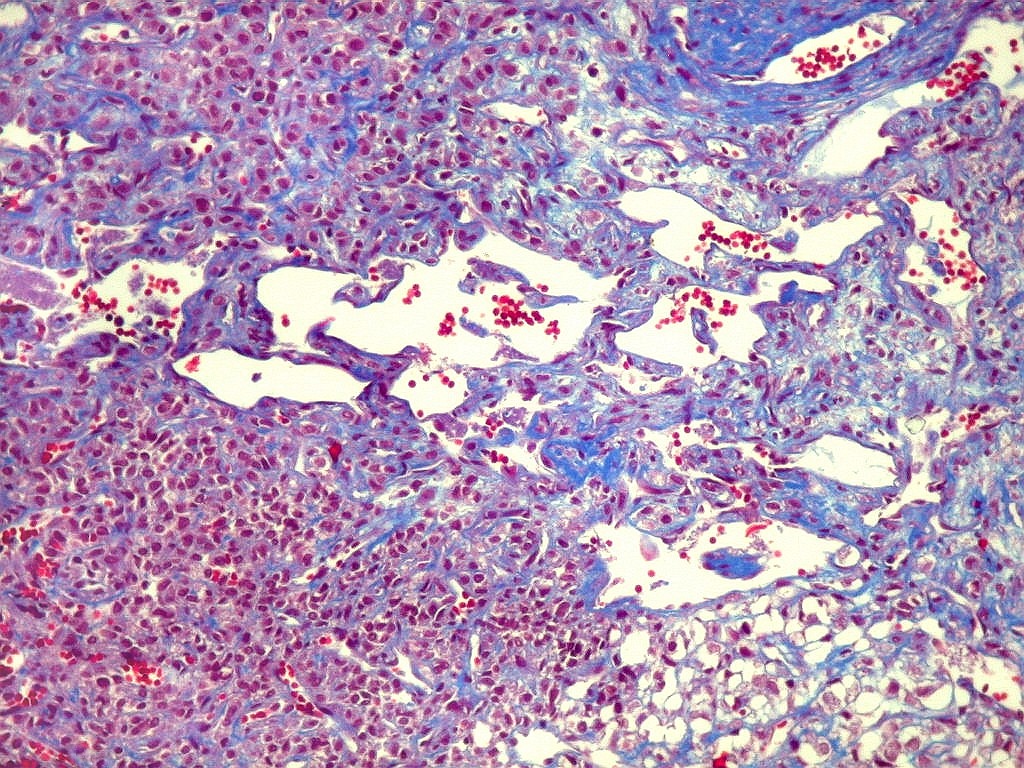 |
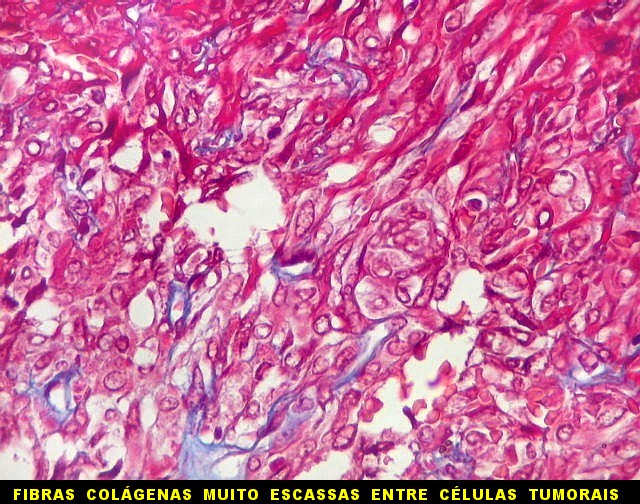
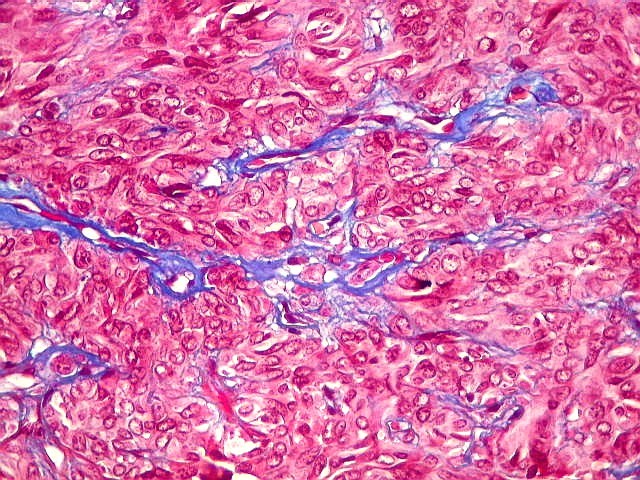
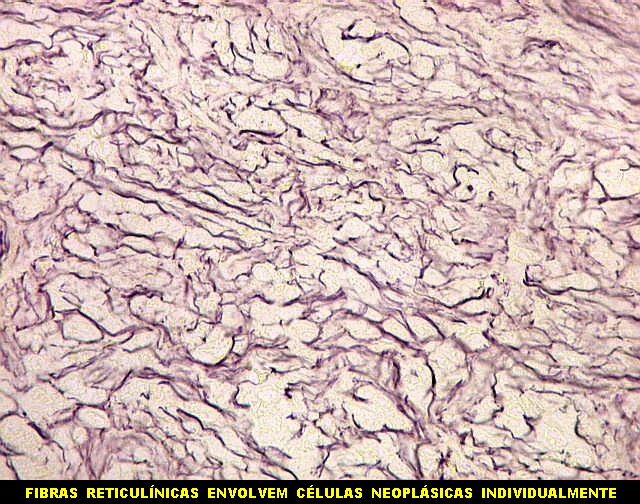
| Masson - tecido tumoral. Como no tumor fibroso solitário, há grande variabilidade na proporção entre células e conjuntivo no hemangiopericitoma. Entre as células neoplásicas, as fibrilas colágenas tendem a ser finas e englobar células individualmente. | |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
| Infiltração dural. Constatada em um caso de hemangiopericitoma e outro de TFS. O Masson destaca a infiltração pelo contraste entre o colágeno (em azul) e as células tumorais (em vermelho), que avançam sobre a dura-máter em lingüetas. | |
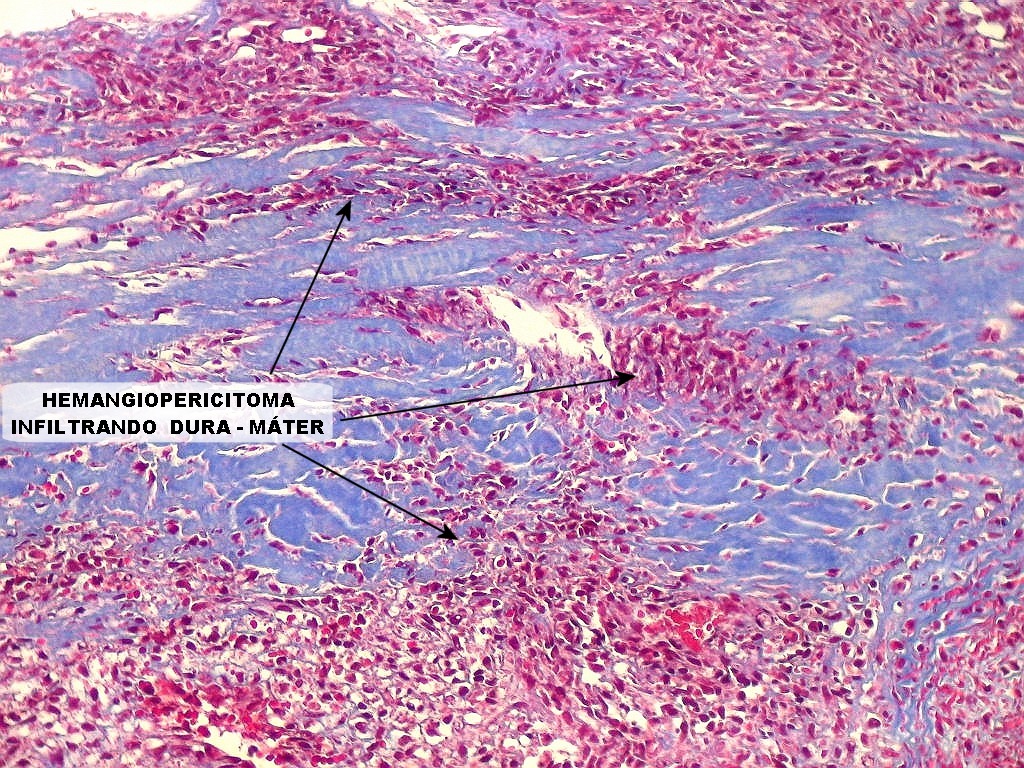 |
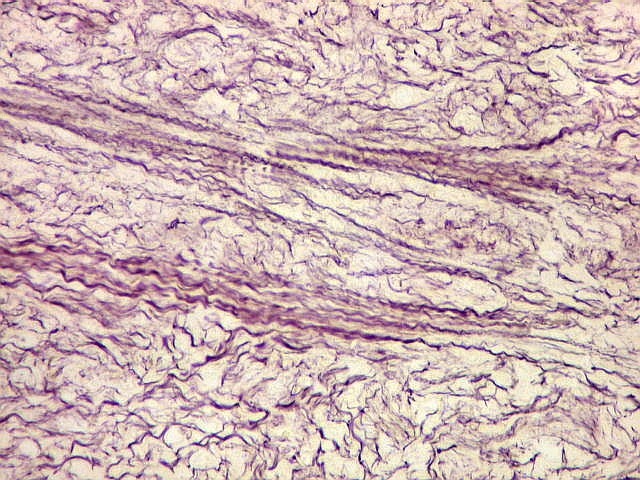
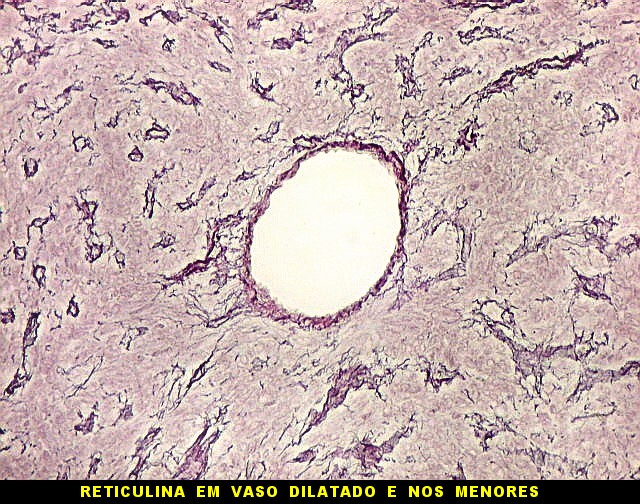
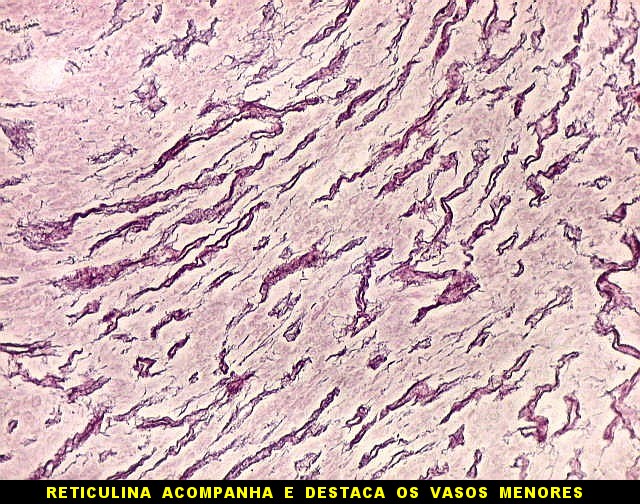
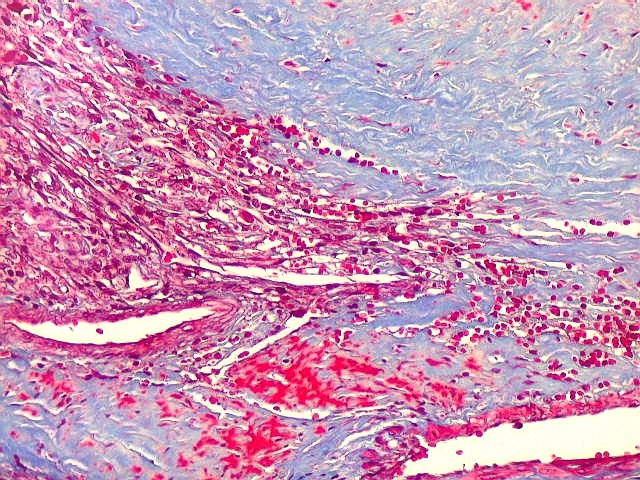 |
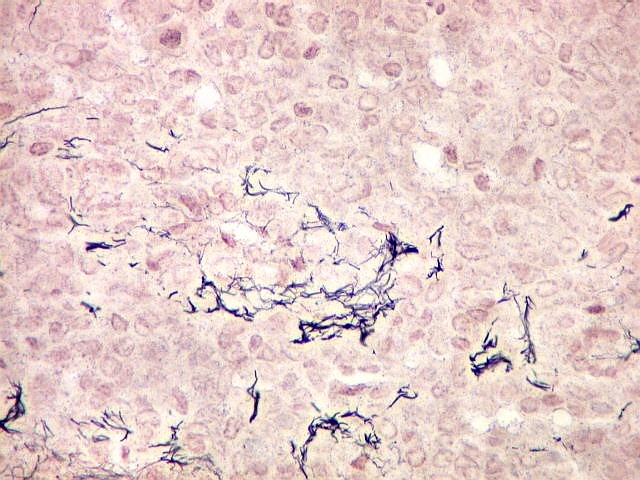
| Reticulina. Repete as nuances entre áreas ricas e pobres em fibras reticulínicas já comentada nos TFS. | |
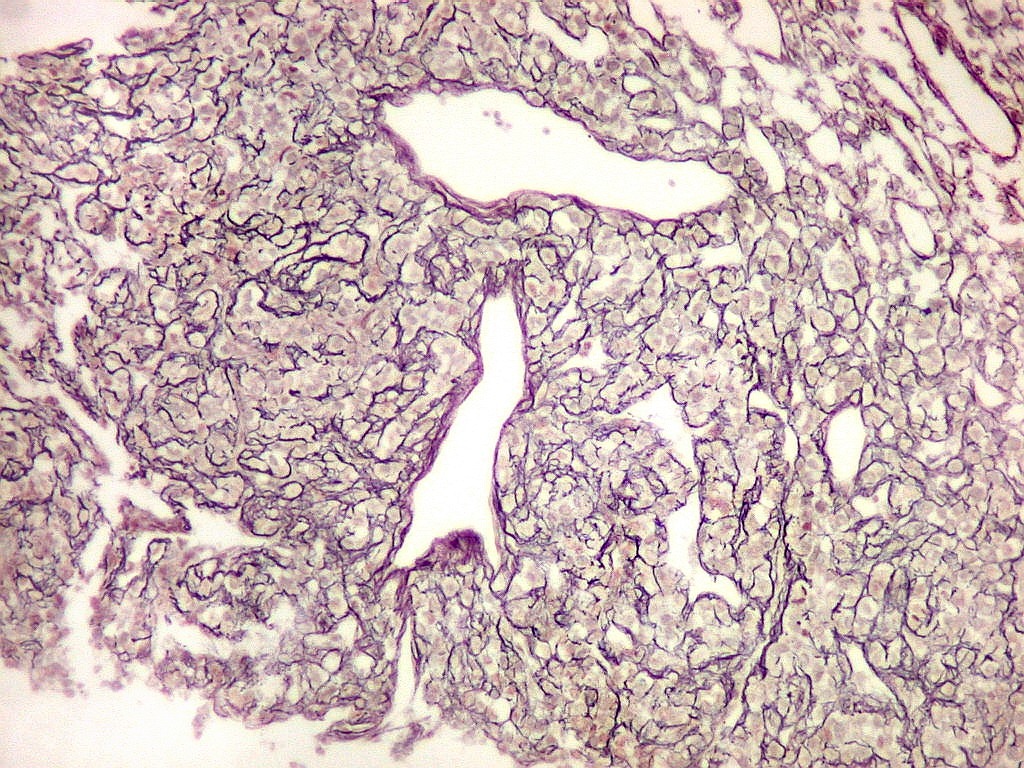 |
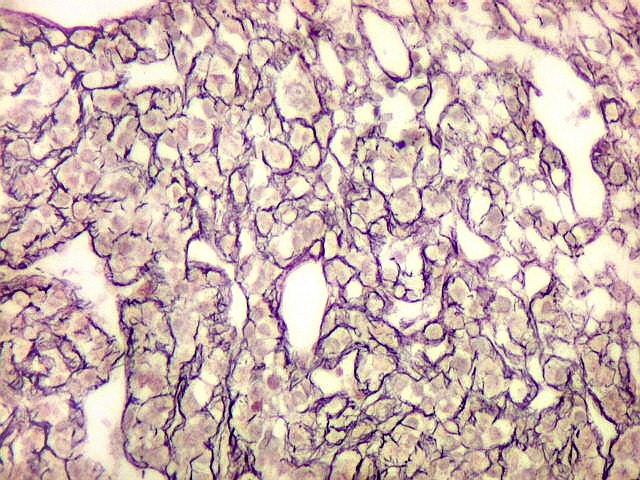 |
 |
 |
 |
 |
 |
|
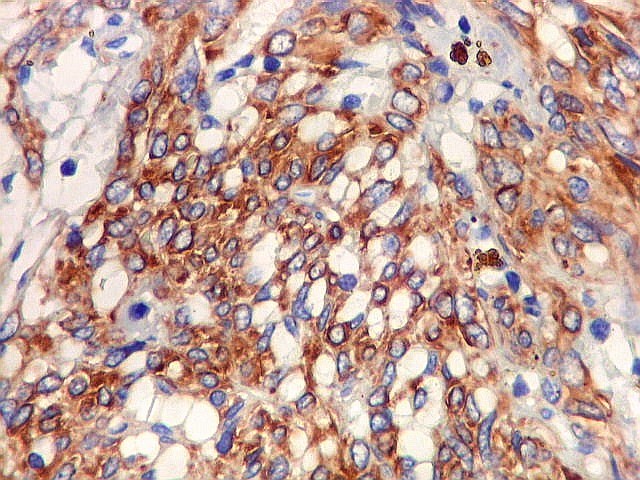
| HPC - IMUNOHISTOQUÍMICA. Os achados são praticamente superponíveis aos com tumor fibroso solitário, aos quais remetemos para comentários. A principal diferença está na reação para CD34, que é mais freqüentemente positiva nas células neoplásicas no TFS que no hemangiopericitoma. Mesmo assim pudemos observar marcação das células neoplásicas em pelo menos um caso. |
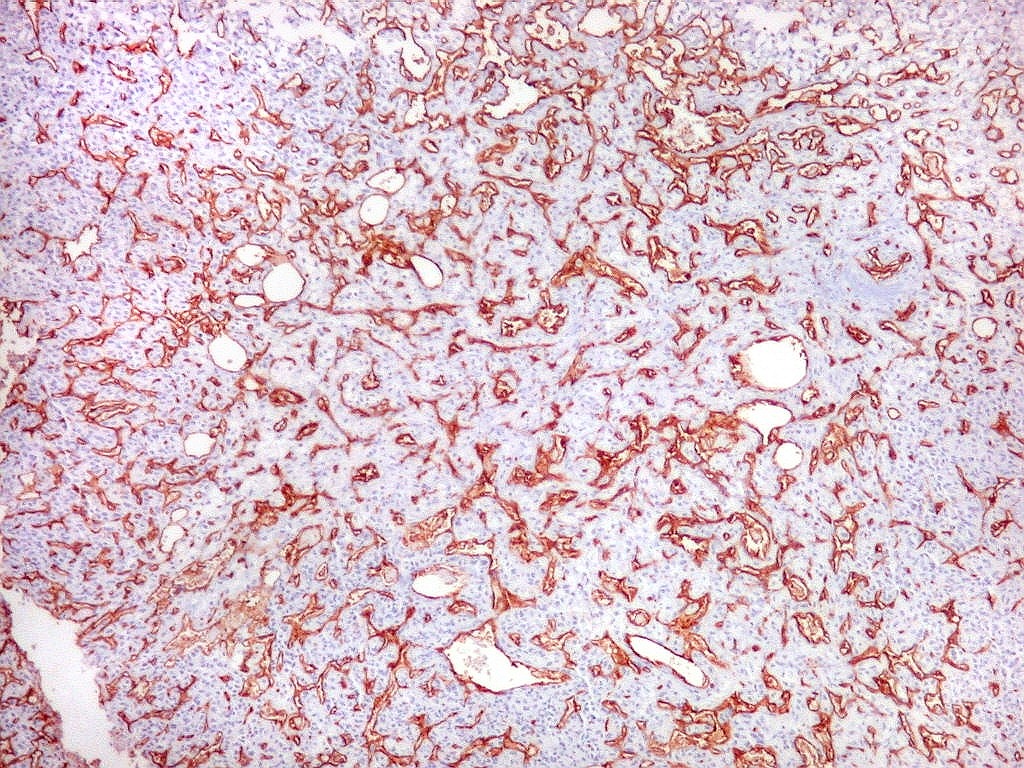
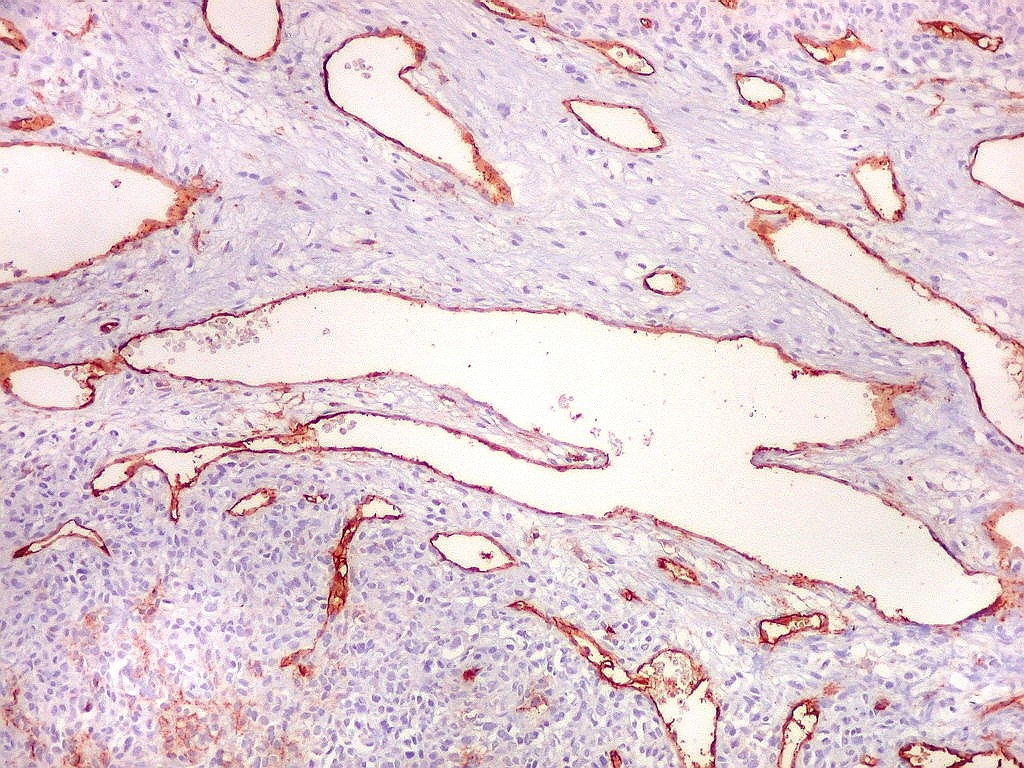
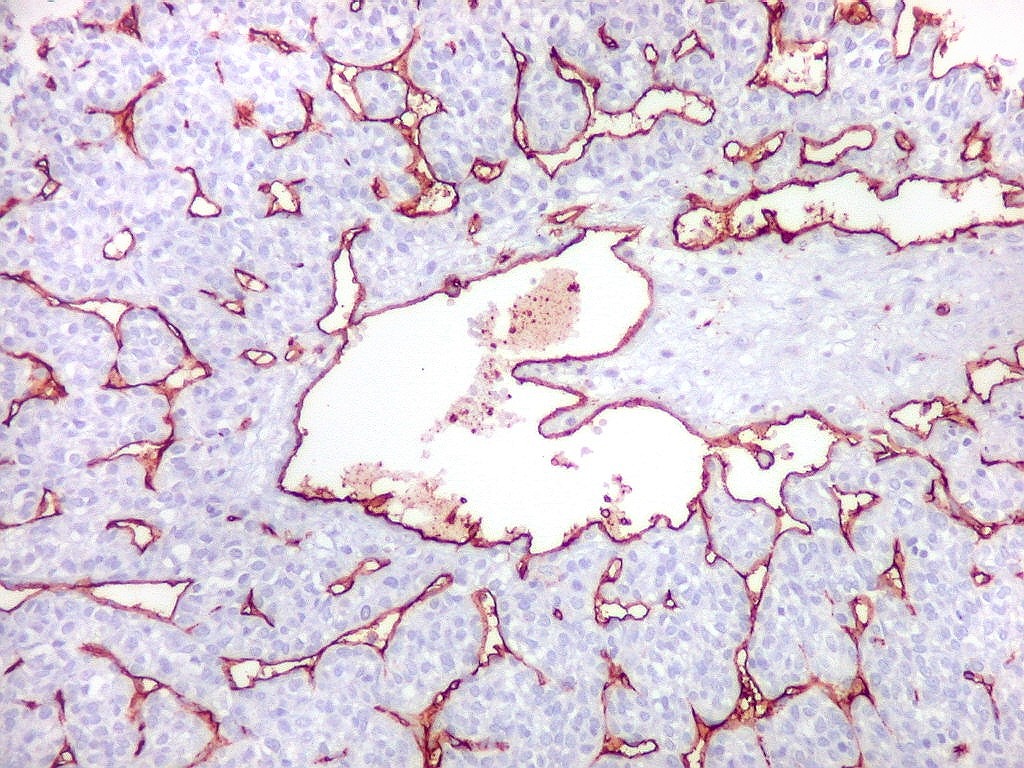
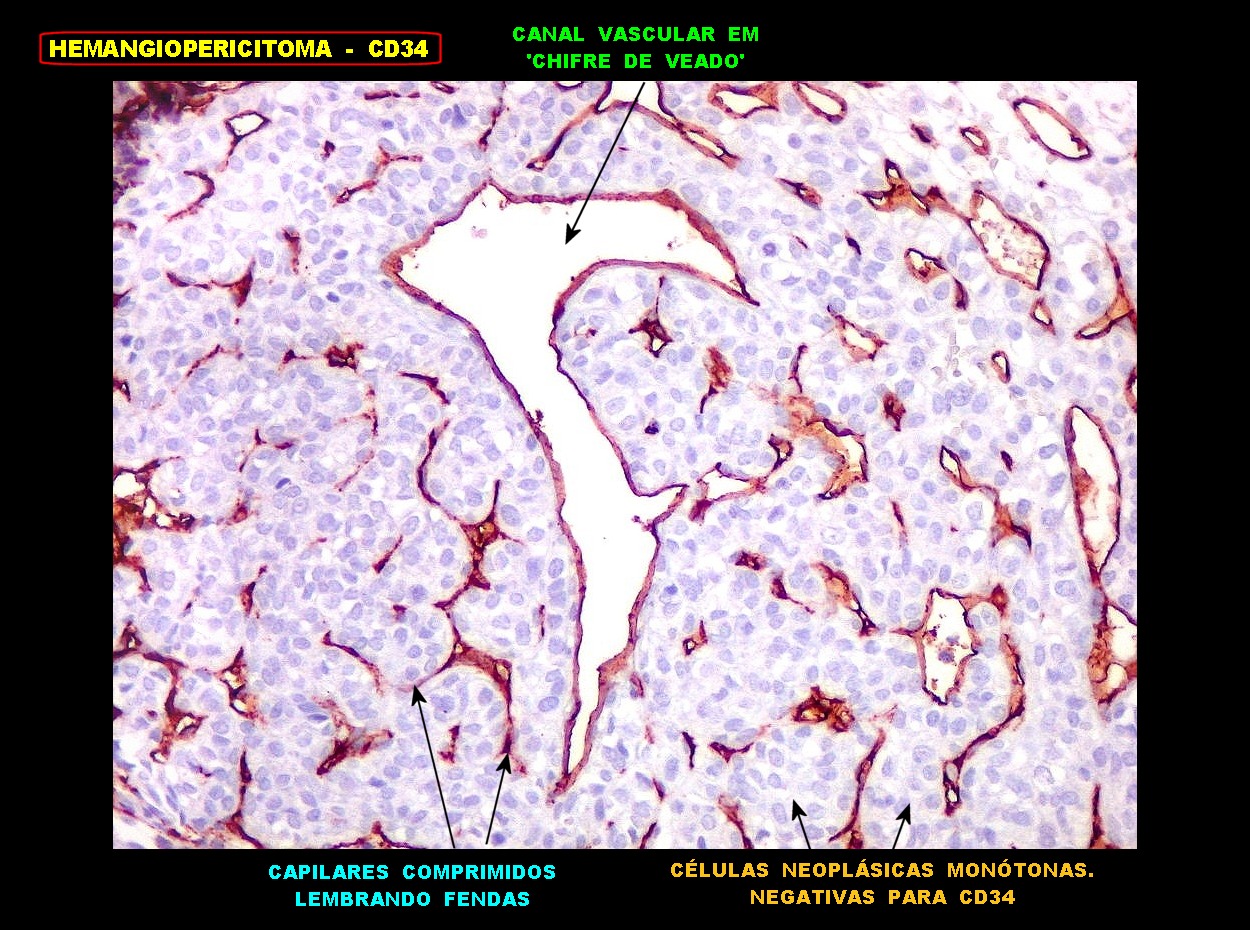
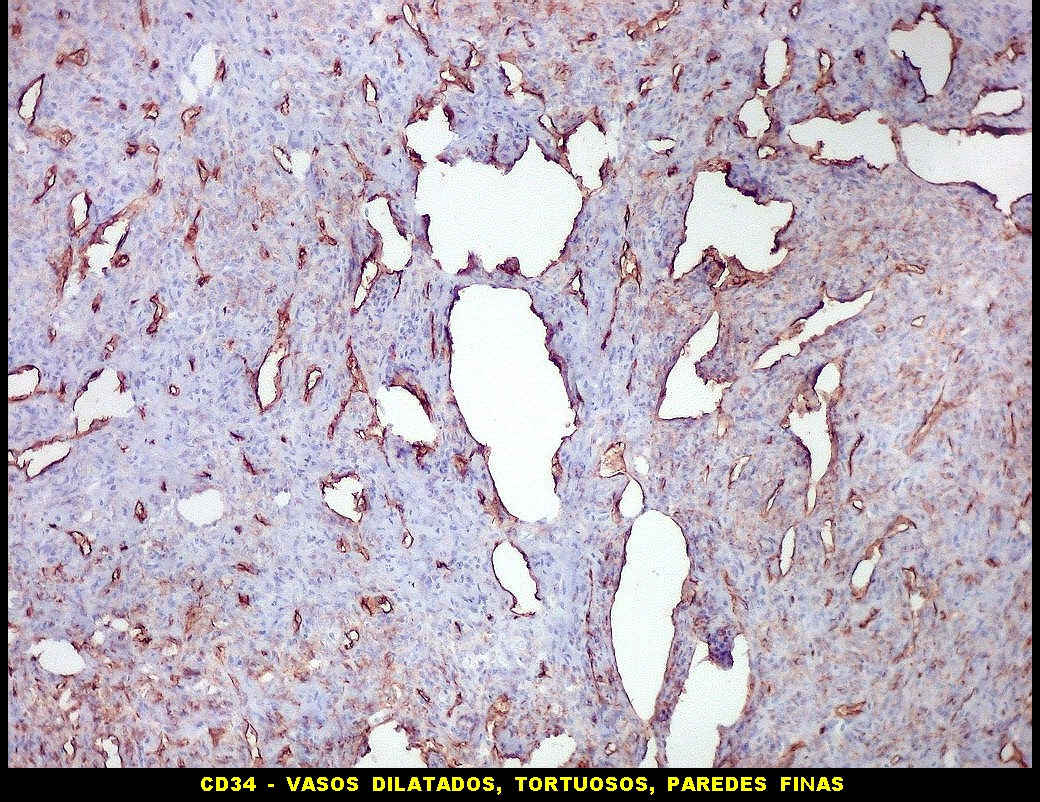
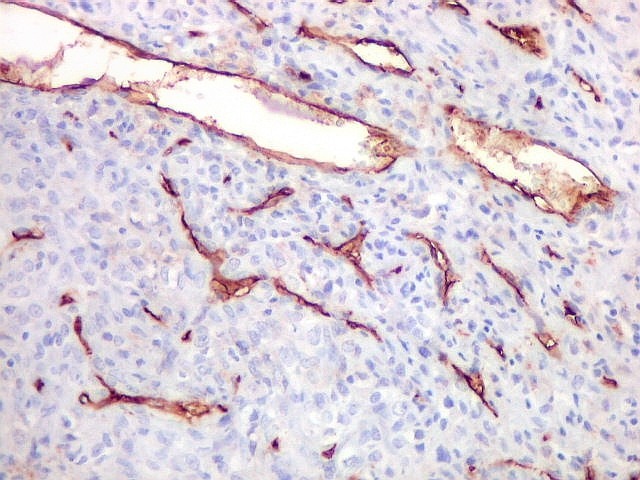
| CD34.
O anticorpo demonstra a riquíssima vascularização deste hemangiopericitoma, através da marcação das células endoteliais dos capilares. As células neoplásicas neste exemplar foram negativas. |
 |
 |
 |
 |
|
 |
 |
 |
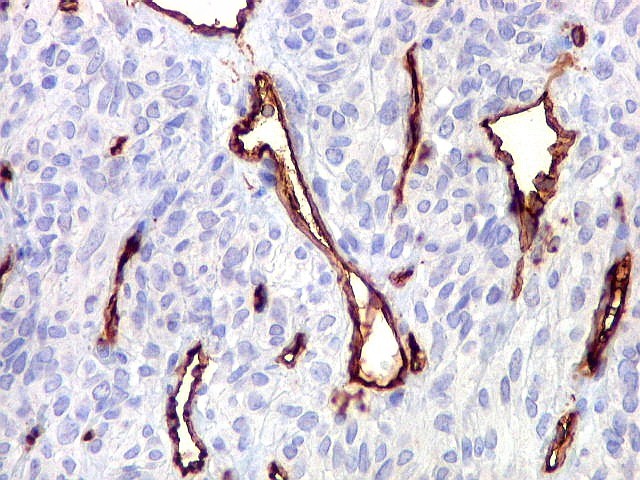 |
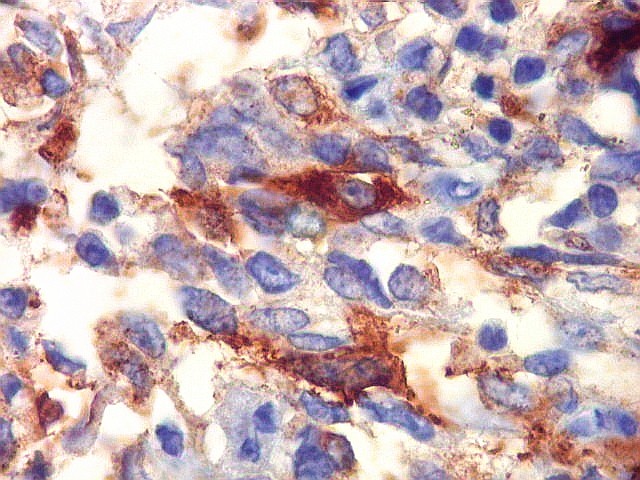
| CD34. Positividade em células do hemangiopericitoma. Embora menos proeminente que no TFS, pode haver marcação de células neoplásicas no citoplasma e/ou membranas. | |
 |
 |
| CD99 | |
 |
|
 |
 |
| BCL-2 | |
 |
|
 |
 |
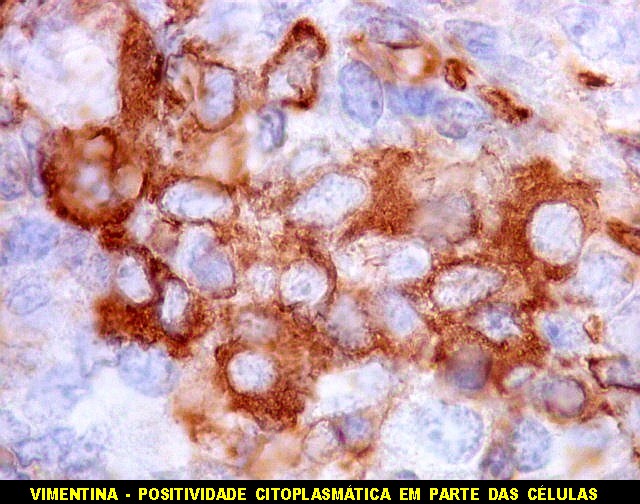
| VIM | |
 |
|
 |
|
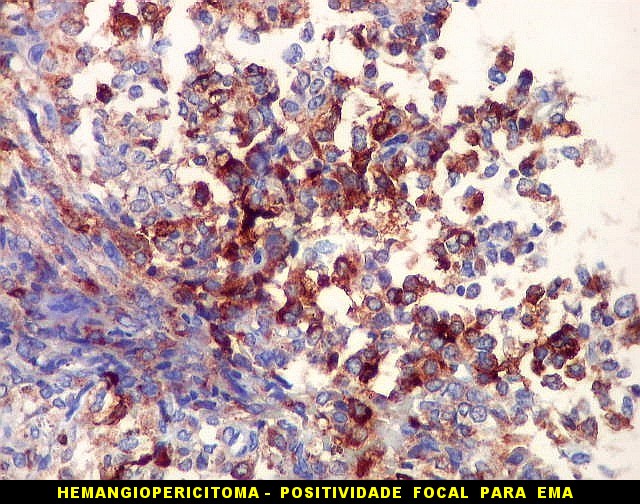
| EMA. | |
 |
 |
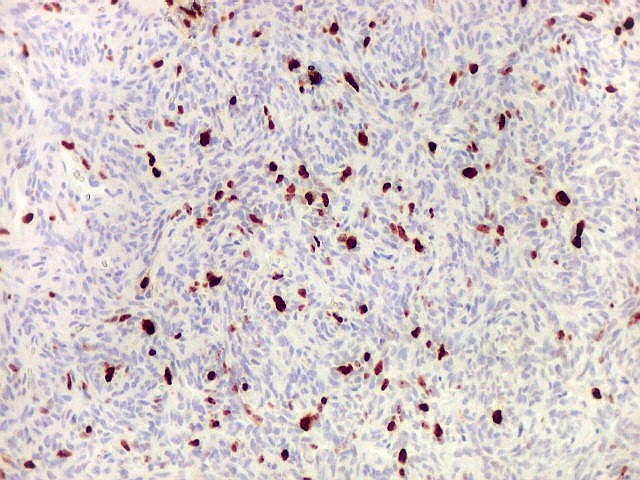
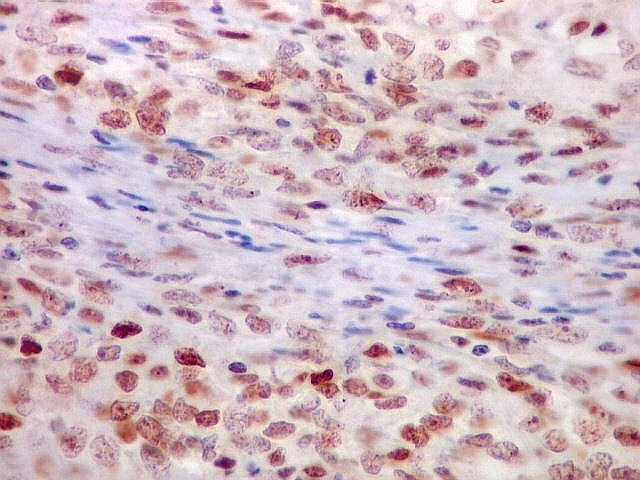
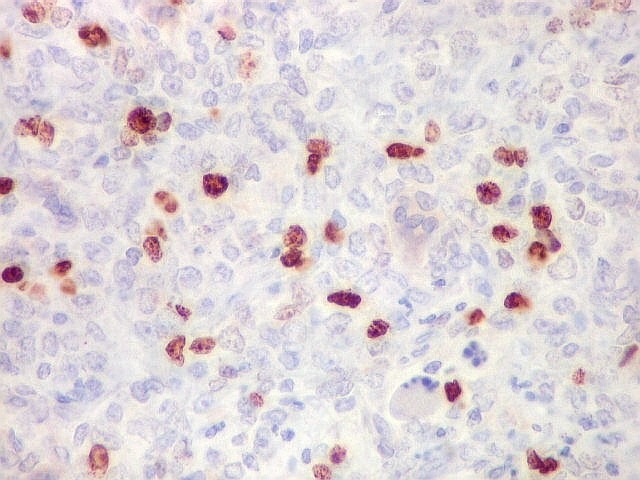
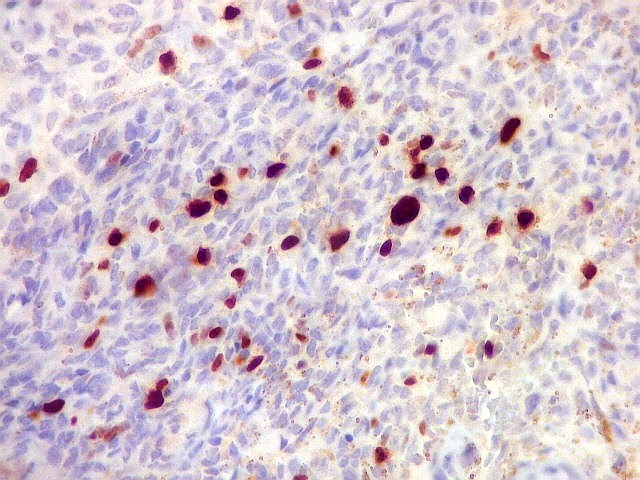
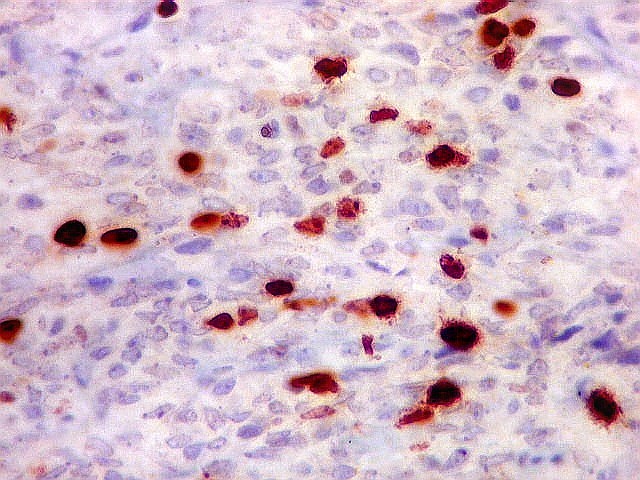
| Ki-67. Abaixo, campos representativos de 3 casos de hemangiopericitoma, mostrando marcação de pelo menos 10% dos núcleos. | |
 |
|
 |
 |
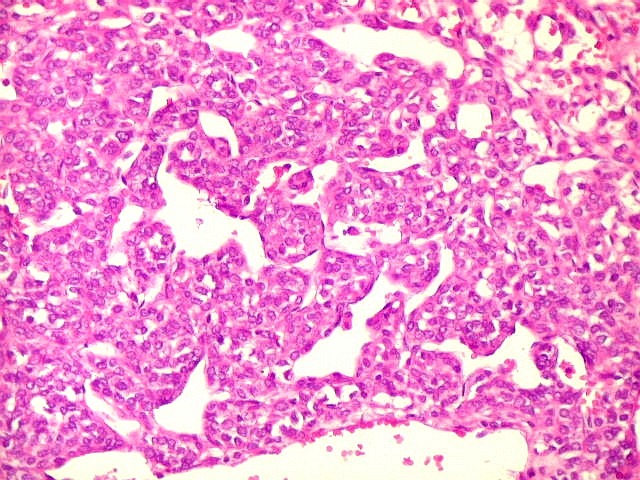
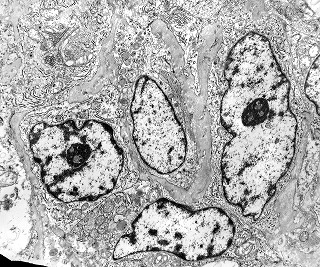
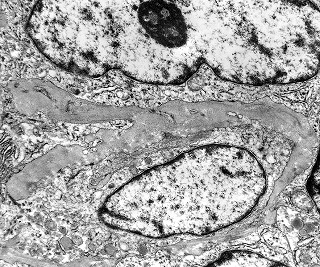
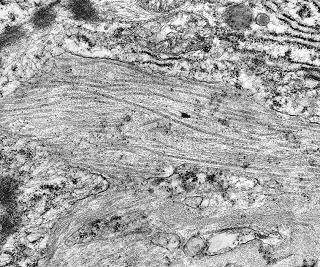
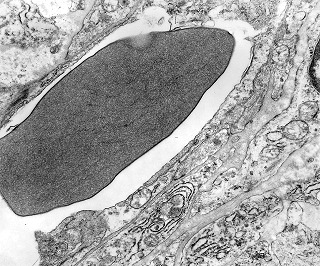
| Destaques da microscopia eletrônica. Caso 2. | ||
| Aspecto geral, células neoplásicas. Regulares, núcleos ovalados, nucléolos proeminentes, citoplasma rico em RER, circundadas por fibras reticulínicas. | Retículo endoplasmático rugoso. Em cisternas concêntricas ou paralelas | Mitocôndrias.
Geralmente escassas, excepcionalmente abundantes.
Junções intercelulares |
 |
 |
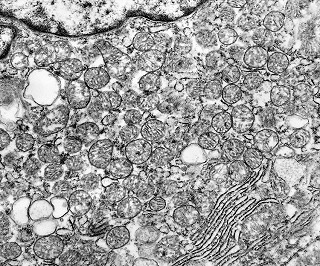 |
| Reticulina. Material eletrodenso amorfo formando traves que separam células incompletamente | Colágeno. Fibras colágenas com estriações transversais mescladas ao material amorfo, em áreas. | Capilar. Células endoteliais delgadas, membrana basal interrompida ou ausente. |
 |
 |
 |
| Texto de
apoio - Tumor fibroso solitário do sistema nervoso central
Tumor fibroso solitário (TFS) do sistema nervoso central é raro e classificado como mesenquimal não meningotelial. Admite-se que se origine em fibroblastos CD34 positivos localizados na dura-máter e tecido conjuntivo perivascular. Tumores intraventriculares derivariam do componente mesenquimatoso do plexo coróide. Incidência. Ocorrem em adultos sem predileção por sexo. Achados clínicos são inespecíficos e dependem da topografia e volume do tumor. Em neuroimagem, aparecem como massas sólidas, geralmente aderidas à dura-máter, que se impregnam por contraste. São virtualmente indistinguíveis de meningiomas, embora o sinal da cauda dural, considerado característico destes, não seja comum nos TFS. Macroscopicamente, são massas sólidas, lobuladas, bem delimitadas e esbranquiçadas. Aqui também a semelhança com meningiomas é acentuada. Histologicamente, os TFS são constituídos por células fusiformes ou ovaladas, com núcleo de cromatina variavelmente frouxa ou densa, e citoplasma róseo de limites imprecisos. Habitualmente há regularidade celular, sem pleomorfismo nuclear, mitoses ou necrose. A quantidade de tecido intersticial, significando riqueza em fibras colágenas / reticulínicas, é variável, com áreas hiper- e paucicelulares por vezes observadas em justaposição. A vascularização é abundante, constituída por capilares finos com paredes extremamente delgadas, não raro formadas apenas por uma camada de células endoteliais. Podem ocorrer áreas com vasos maiores, dilatados, em ramificação irregular, comparada a ‘chifres de veado’, como também observado nos hemangiopericitomas. Em imunohistoquímica, TFS são positivos de forma difusa e intensa para vimentina, CD34, CD99 e BCL-2, que são usados para firmar o diagnóstico. Habitualmente, EMA, citoqueratinas e proteína S-100 são negativos, mas podem mostrar positividade focal em alguns casos, o que não invalida o diagnóstico. Na literatura, o índice Ki-67 é mencionado como < 2%, mas observamos valores entre 5 e 10% nos nossos casos. O diagnóstico diferencial com meningiomas geralmente não apresenta dificuldades, dado que estes se caracterizam pela ocorrência comum de redemoinhos, corpos psamomatosos, bem como fibras colágenas espessas entre as células. São também caracteristicamente positivos para EMA e negativos para CD34. Bem mais difícil é a distinção entre os TFS e os hemangiopericitomas (HPC). A convergência morfológica é tamanha que cresce a suspeita de que sejam a mesma entidade, ou pontos de um espectro. Histologicamente, a arquitetura e morfologia das células é virtualmente superponível. Os vasos dilatados, tortuosos e de paredes finas, não raro com ramificação em chifres de veado (staghorn branching) são encontrados em ambos. Nos casos que examinamos, o termo hemangiopericitoma foi aplicado àqueles que mostravam na RM imagens de flow void marcantes, indicando um caráter quase angiomatoso do tumor. Imunohistoquimicamente, admite-se que os TFS são CD34 positivos nas células, enquanto os HPC seriam negativos. Mas este argumento é frágil, pois tanto nos casos que classificamos como HPC como TFS há áreas CD34 positivas e negativas. Biologia molecular. Evidência recente veio reforçar a semelhança entre estas entidades, mostrando que tanto TFS como HPC meníngeos mostram fusão dos genes NAB2 e STAT6, localizados em grande proximidade no cromossomo 12q13. NAB2 é uma proteína nuclear moduladora de transcrição gênica, e STAT6 é um transdutor citoplasmático de sinal e ativador de transcrição. A fusão resulta numa proteína quimérica na qual o domínio repressor de NAB2 é substituído pelo domínio carboxi terminal de STAT6. A expressão nuclear da parte carboxi terminal de STAT6 pode ser identificada por imunohistoquímica. Esta anormalidade genética sendo encontrada em ambos os tipos de tumor (TFS e HPC) favorece fortemente que se tratem de uma só entidade, e que diferenças entre eles, como o grau de vascularização e a positividade para CD34, sejam secundárias e de menor importância. No trabalho de Schweizer et al., a realocação nuclear de STAT6 foi detectada em 35/37 hemangiopericitomas, 25/25 tumores fibrosos solitários meníngeos, e em 0/87 meningiomas. É digno de nota que, enquanto na classificação de tumores do sistema nervoso da OMS (2007), TFS e HPC são tratados em capítulos distintos, ambos são considerados variantes de uma mesma entidade na Classificação da OMS de tumores de osso e partes moles (2013). Naquele capítulo, hemangiopericitoma é considerado sinônimo (obsoleto) de TFS extrapleural. Fonte: Rogerio F, Queiroz LS. Intracranial solitary fibrous tumor with atypical histologic features and distant bone metastases. Brain Pathology Case of the Month - November 2014 (publicação prevista para março 2015). Outras referências.
|
| Tumor fibroso
solitário extrapleural
Tumor fibroso solitário extrapleural é um tumor mesenquimatoso ubiquitário, do tipo fibroblástico, com padrão vascular de ramificações proeminentes do tipo hemangiopericitoma. No passado, a maioria destes tumores era denominada hemangiopericitoma. Incidência. Ocorrem na maior parte em adultos entre 20 e 70 anos, sem predileção por sexo. Localização. 40% no tecido subcutâneo, tecidos moles profundos de extremidades, região de cabeça e pescoço (especialmente órbita), parede torácica, mediastino, pericárdio, retroperitônio, cavidade abdominal. Outras – meninges, inclusive medula espinal, glândula salivar, pulmão, tiróide, fígado TGI, adrenal, rim, bexiga, próstata, canal espermático, testículo, osso e pele. Há uma variante formadora de gordura que afeta os tecidos moles profundos de várias localizações, inclusive extremidades inferiores (coxa), tronco, regiões abdomino-pélvicas (especialmente retroperitônio), cabeça e pescoço. Clínica / macro. Os tumores apresentam-se como massas bem delimitadas, indolores e de crescimento lento. Quando grandes, podem dar sintomas compressivos na cavidade nasal, órbita e meninges. Há tumores malignos localmente infiltrativos. Medidas vão de 1 a 25 cm. (mediana 5 -8 cm). Consistência firme. Em corte, são multinodulares, esbranquiçados. Áreas hemorrágicas ou mixóides são incomuns. Micro. TFS mostram áreas hiper e hipocelulares separadas por bandas espessas de colágeno hialinizado, às vezes lembrando quelóide. Os vasos são de paredes finas e ramificados, lembrando os hemangiopericitomas. As células neoplásicas são ovóides a fusiformes, com citoplasma róseo relativamente escasso e limites imprecisos. Os núcleos são vesiculosos com cromatina dispersa. Raramente, células epitelióides ou rabdóides podem ser encontradas focalmente. Pode haver áreas mixóides, áreas de fibrose e mastócitos. Mitoses raramente excedem 3 por 10 campos de grande aumento. TFS malignos são usualmente hipercelulares, com aumento no índice mitótico (>4/10 campos de grande aumento), atipia citológica variável, necrose e margens infiltrativas. O índice mitótico parece ser o de maior importância prognóstica. Pode haver transição para áreas de sarcoma de alto grau. IH. Células tumorais são caracteristicamente positivas para CD34 (90-95% dos casos), Há positividade para EMA e SMA (smooth muscle actin ou 1A4) em 20-35% dos casos. Reatividade focal e limitada tem sido relatada para S-100, queratinas ou desmina. Mutações em p53 são raras, mas hiperexpressão foi observada em áreas sarcomatosas. Prognóstico. A maioria dos casos é benigna, mas o comportamento pode ser imprevisível. Cerca de 10% são agressivos, com recidivas locais e à distância muitos anos após cirurgia. Não há correlação estrita entre histologia e prognóstico. Índice mitótico elevado é o melhor indicador de agressividade, assim como tumores maiores que 10 cm e invasão das margens. Tumores apenas com atipias têm comportamento incerto. Lesões no tronco e nas meninges tendem a ser mais agressivas que as nos membros. Metástases são mais freqüentes em pulmões, ossos e fígado. Fonte: Fletcher, C. D.M., Bridge, J.A, Lee, J-C. (2013) Extrapleural Solitary fibrous tumour. In WHO Classification of Tumours of Soft Tissue and Bone, Volume 5, 4th Ed. Fletcher, C. D.M., Bridge, J.A., Hogendoorn, P., Mertens, F. IARC Press, Lyon. pp. 80-2. |
| Módulo Neuro - Página Inicial | Outros módulos | Técnicas histológicas | e-mails : [email protected]_
__[email protected] |
|
|
|
|