|
|
1. HE, tricrômico de Masson. |
|
|
|
1. HE, tricrômico de Masson. |
|
| Masc. 36 a. Clique para TC, HE, Masson. IH - CD68, HAM5.6, 1A4, vimentina, CD34, Ki67. Textos: hiperparatiroidismo, tumor marrom. |
| Destaques da microscopia. | ||
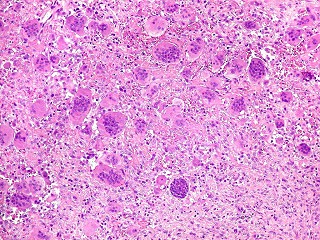
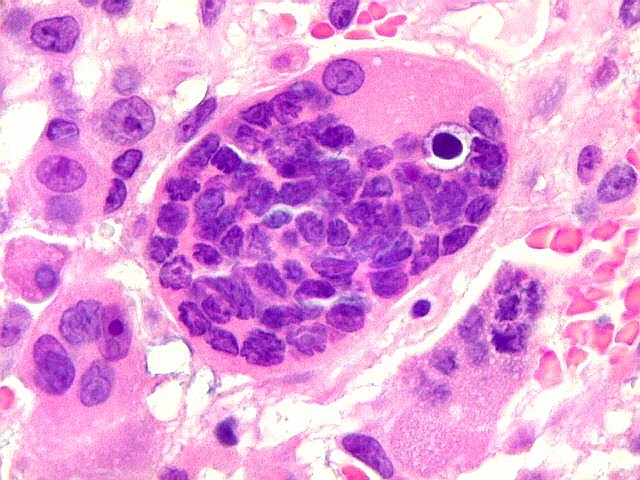
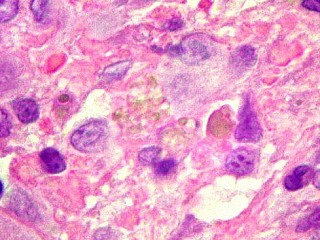
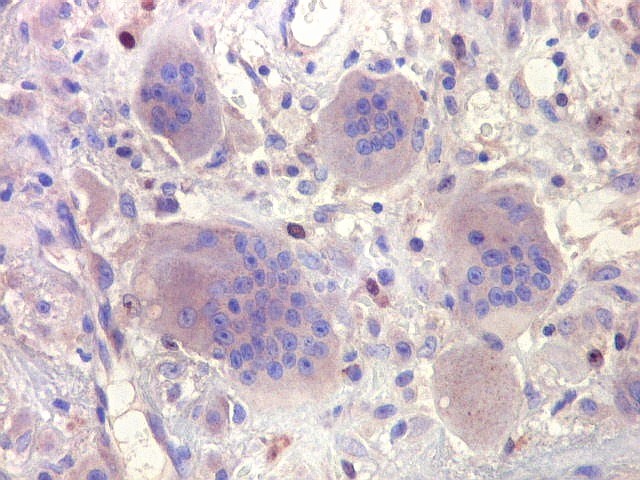
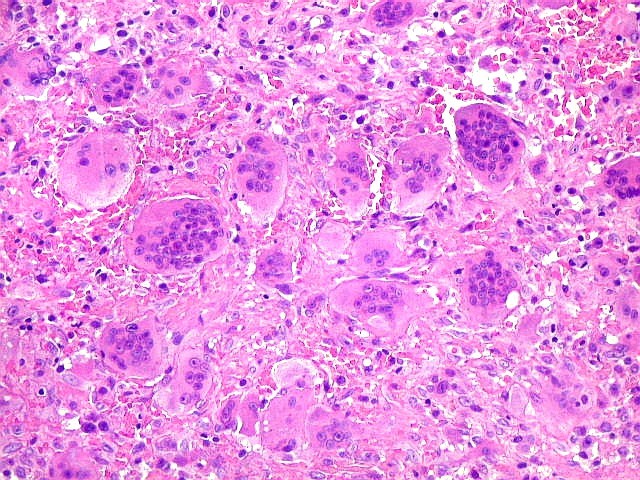
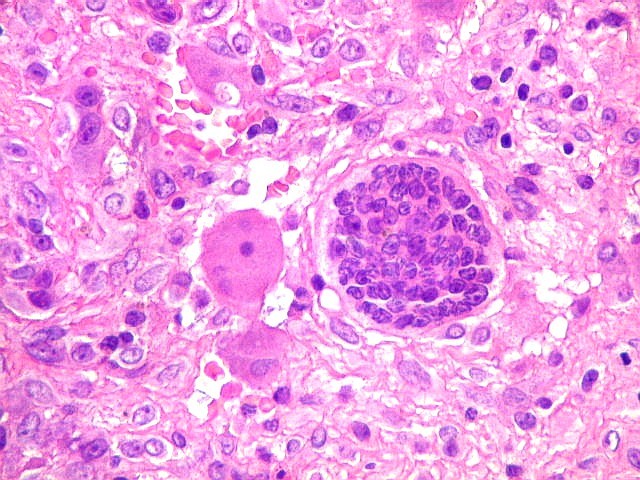
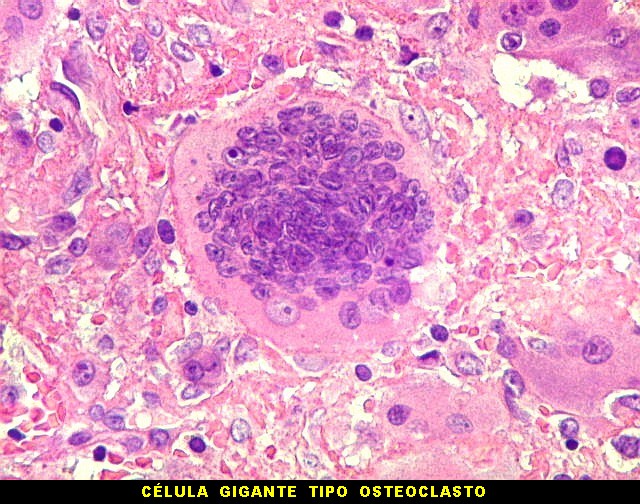
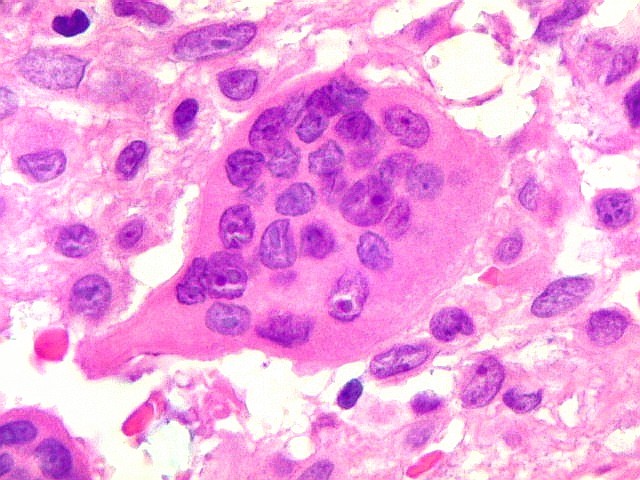
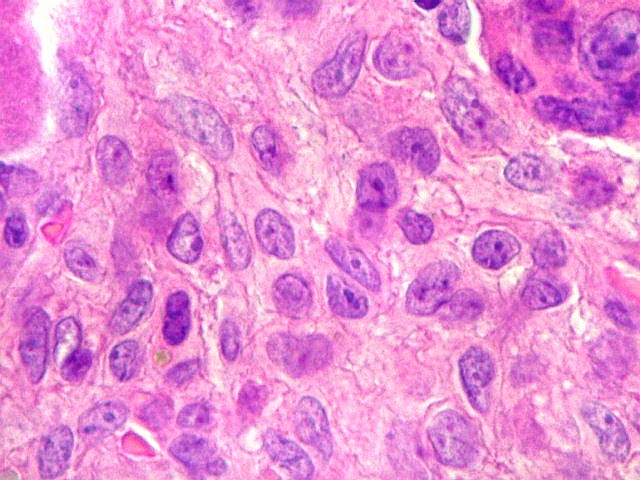
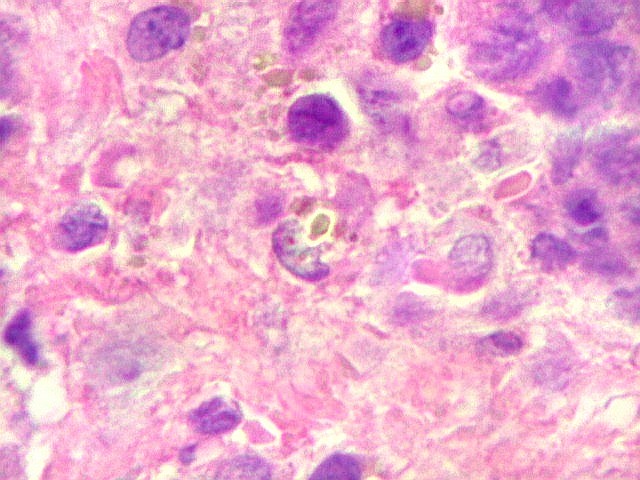
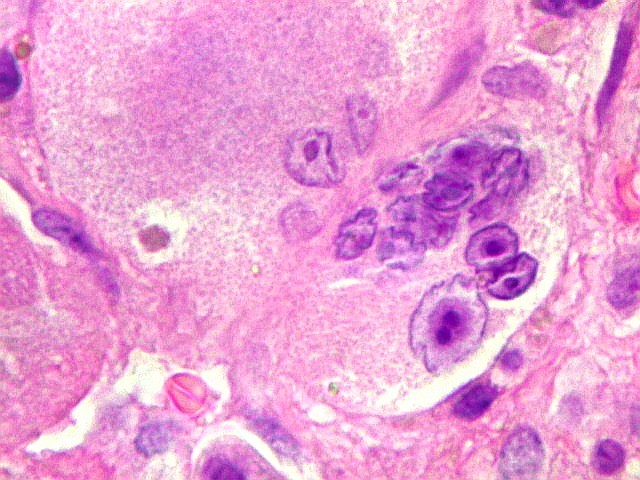
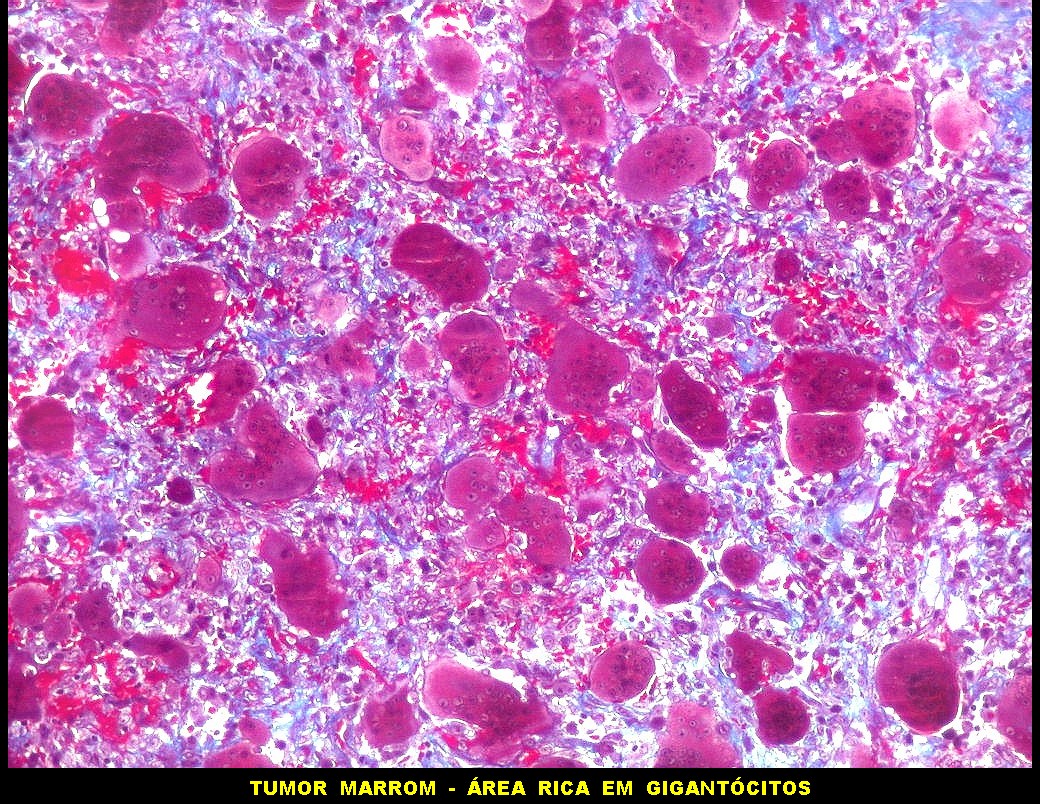
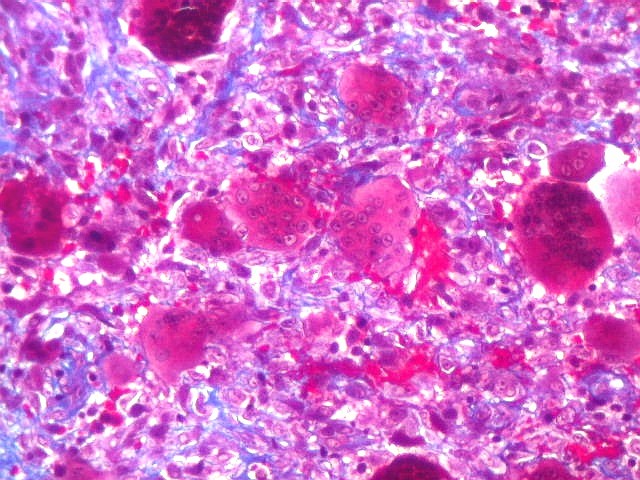
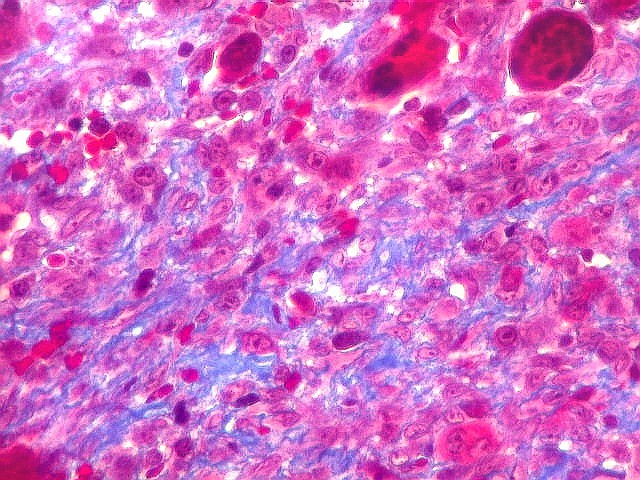
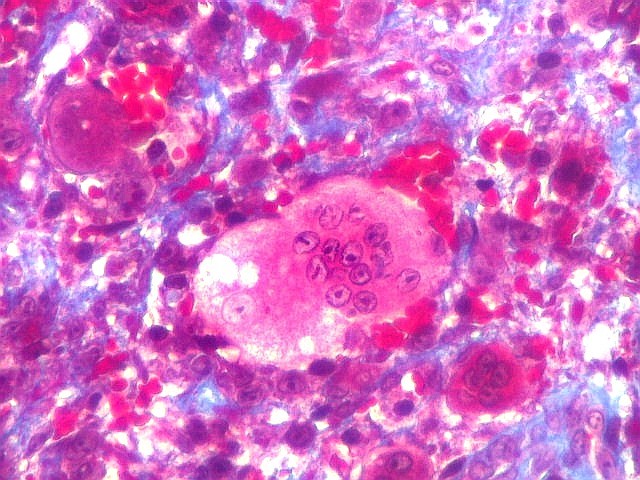
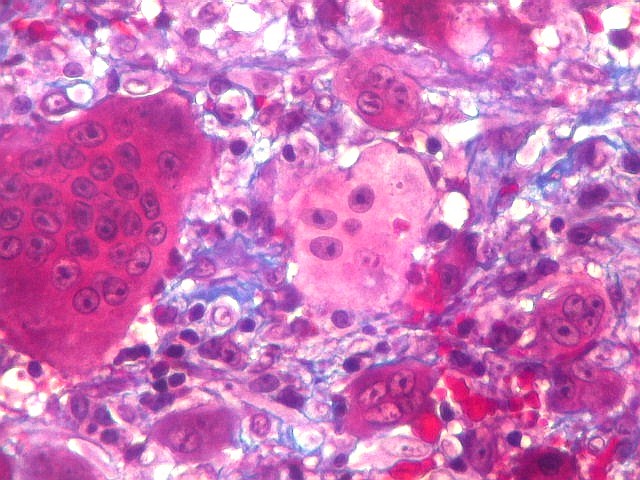
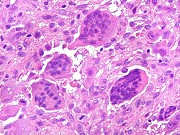
| HE. Coexistência de células mononucleares estromais (macrófagos e miofibroblastos) e células gigantes do tipo osteoclasto | Gigantócitos multinucleados do tipo osteoclasto | Células mononucleares estromais (macrófagos e miofibroblastos) |
 |
 |
 |
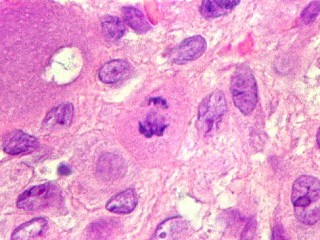
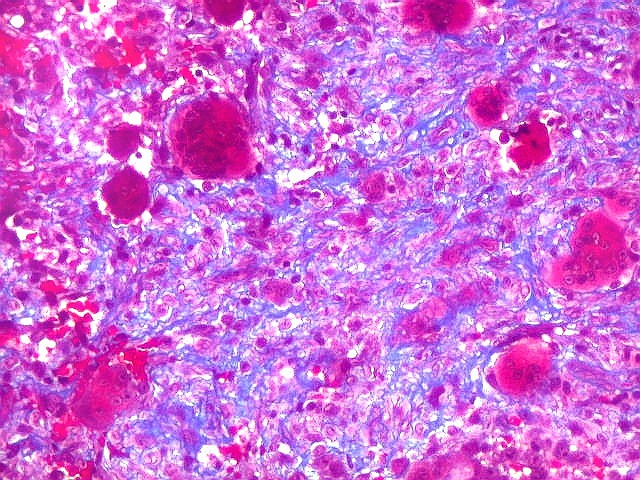
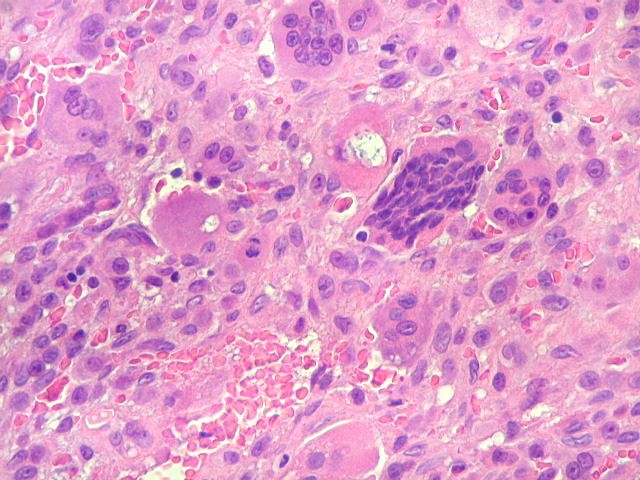
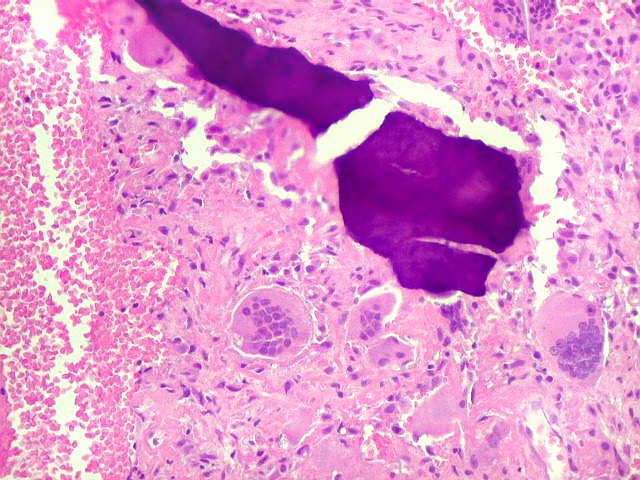
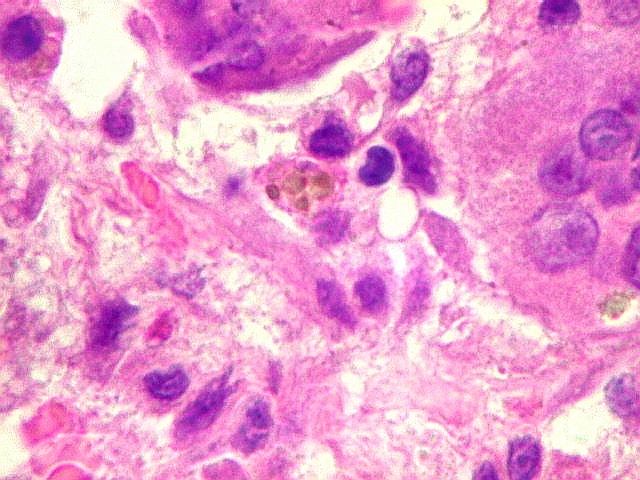
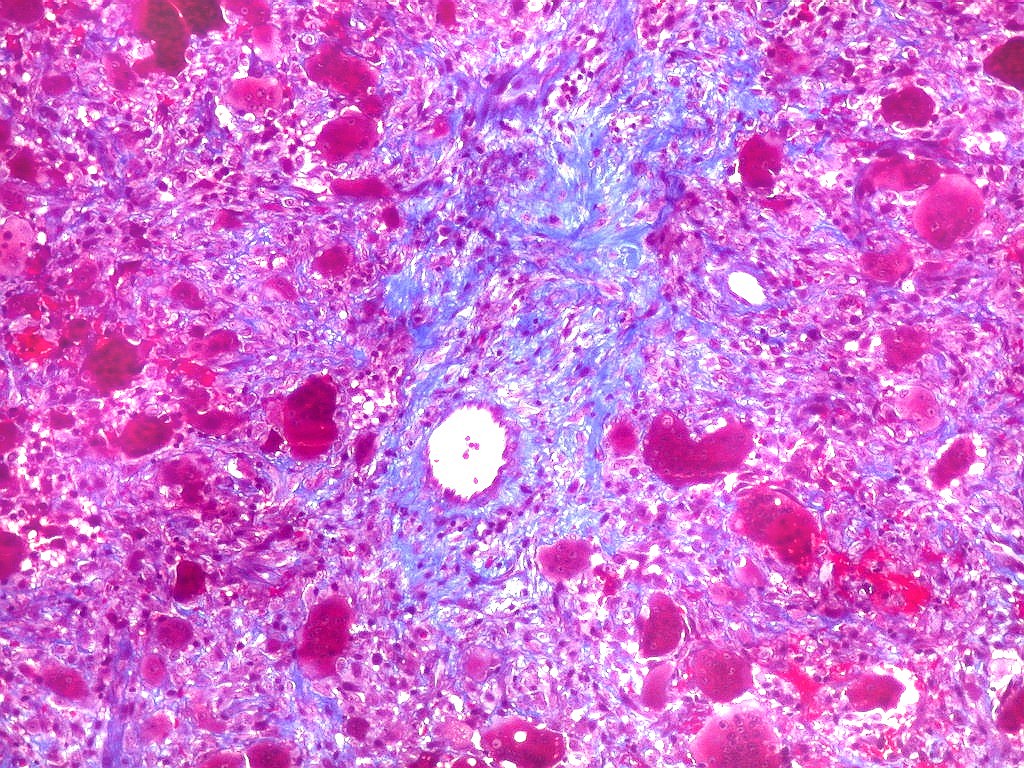
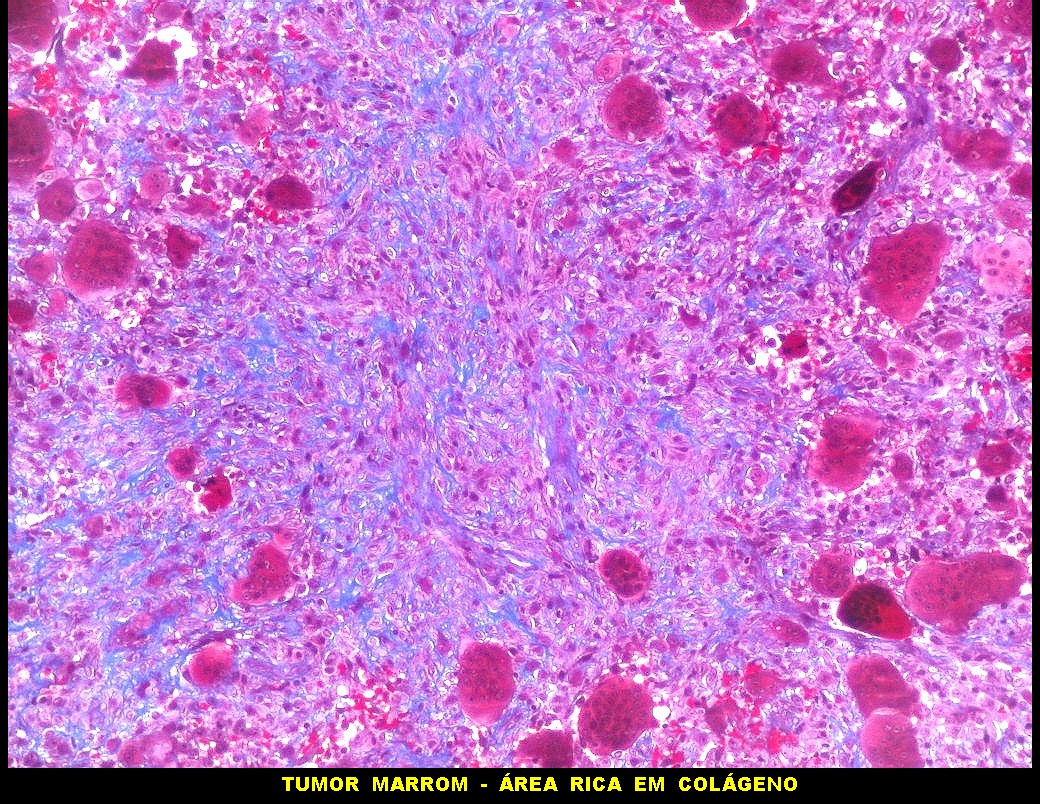
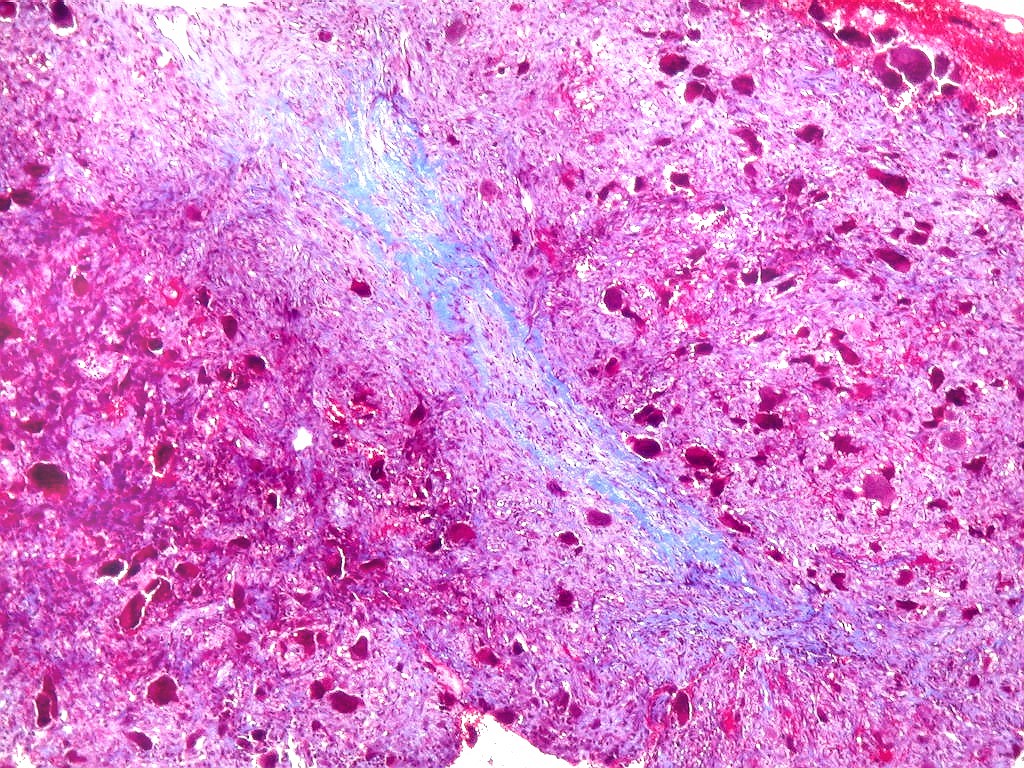
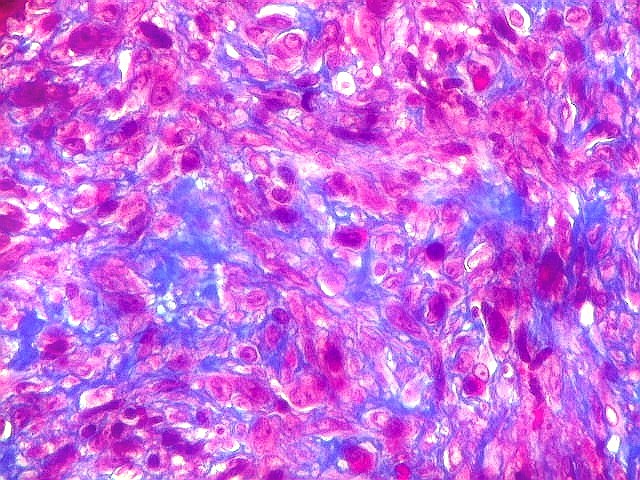
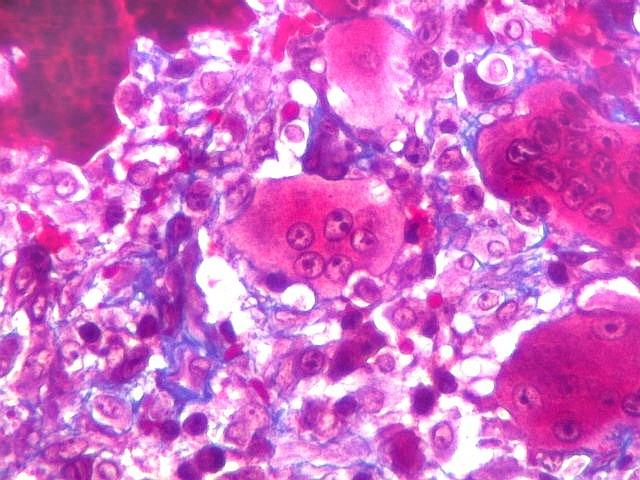
| Mitoses escassas, só nas células mononucleares. | Grânulos de hemossiderina | Masson. Áreas ricas em fibras colágenas |
 |
 |
 |
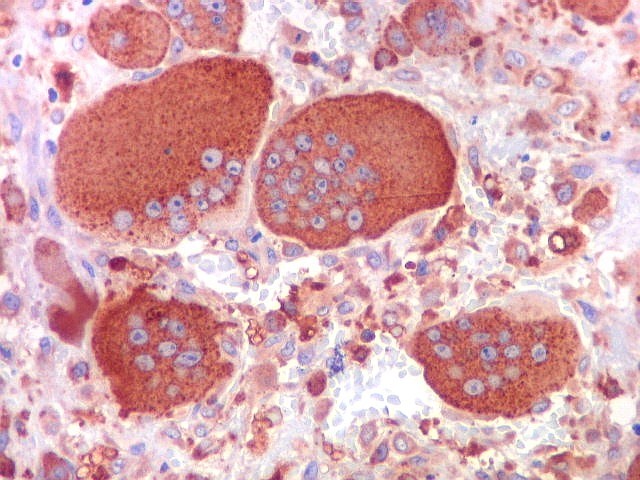
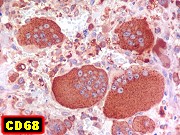
| CD68. Positividade universal nas células gigantes multinucleadas | Positivo em parte das células mononucleares (macrófagos) | Negativo em parte das células mononucleares (miofibroblastos) |
 |
 |
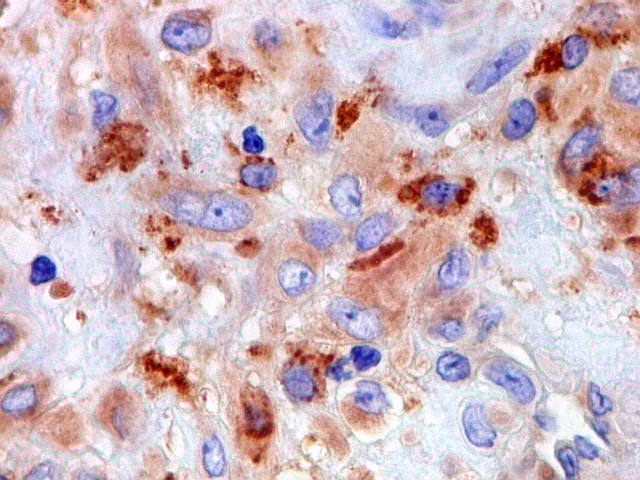 |
| HAM56. Positivo em parte das células mononucleares (macrófagos), mas negativo nas células gigantes multinucleadas | 1A4. Positividade em parte das células mononucleares (miofibroblastos). Sempre negativo nos gigantócitos | VIM. Positividade citoplasmática nas células mononucleares. Gigantócitos são parte positivos, parte negativos. |
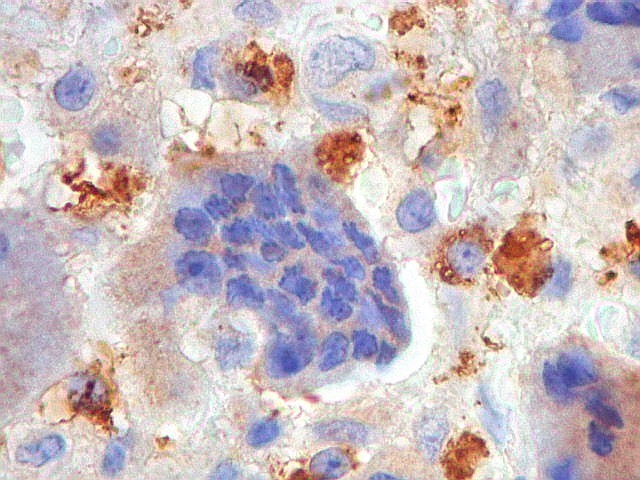 |
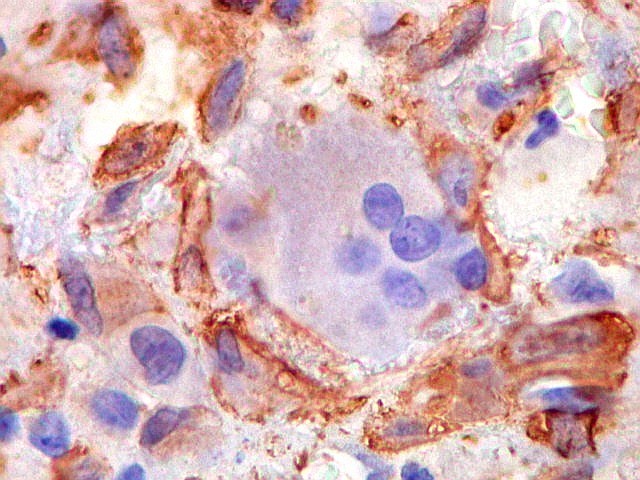 |
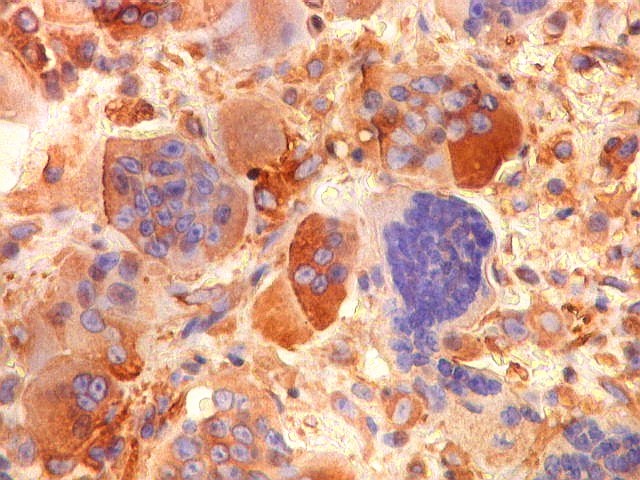 |
| CD34. Positivo em vasos, negativo nas células estromais e gigantes | Ki-67. Sempre negativo nos gigantócitos | Ki-67. Positividade em cerca de 20% das células estromais |
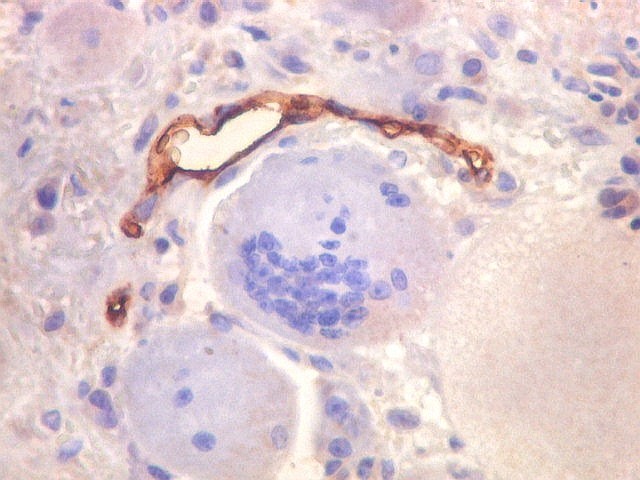 |
 |
 |
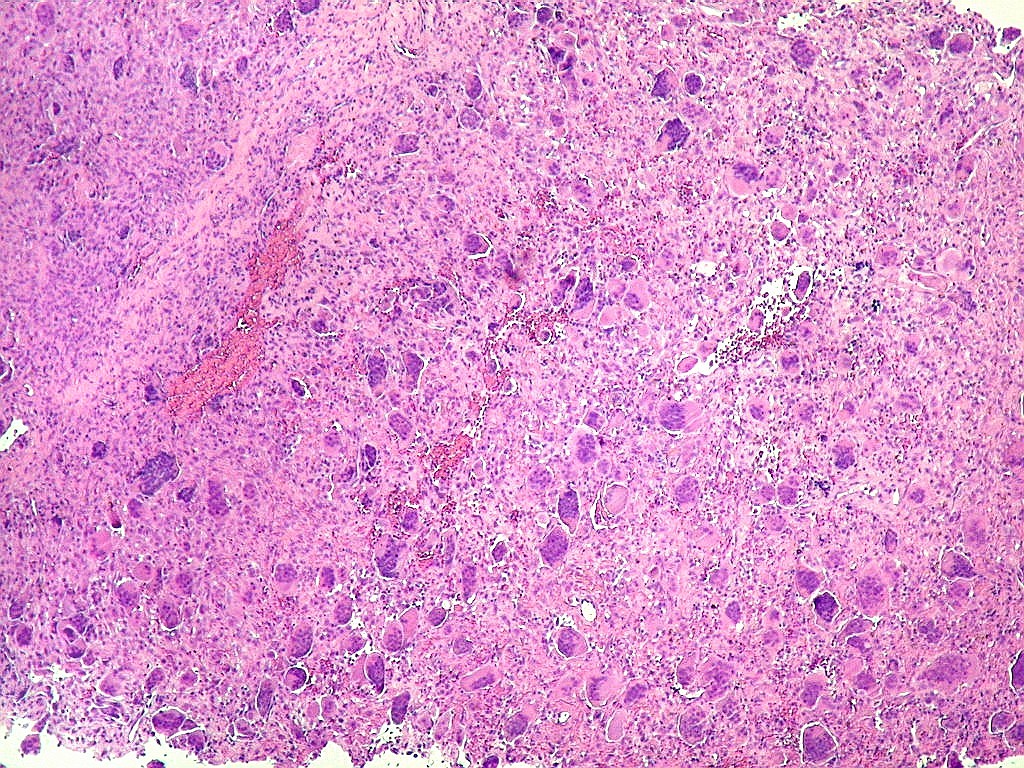
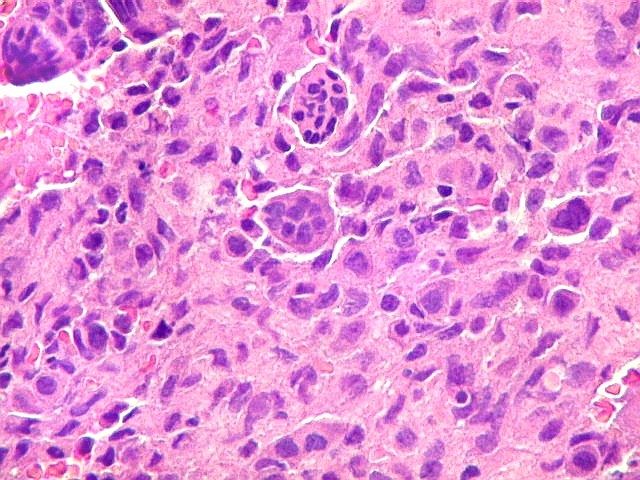
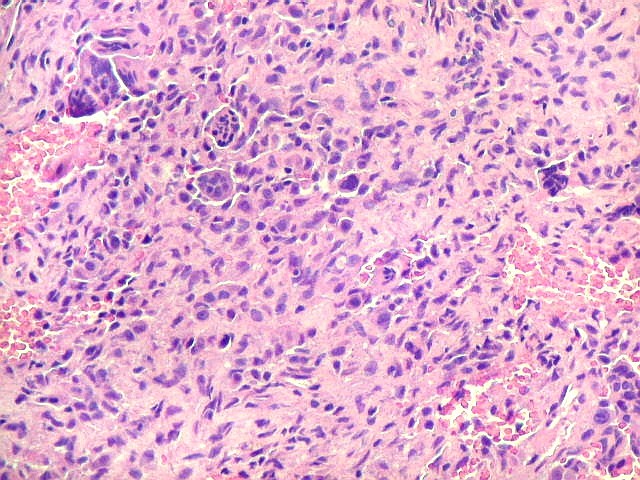
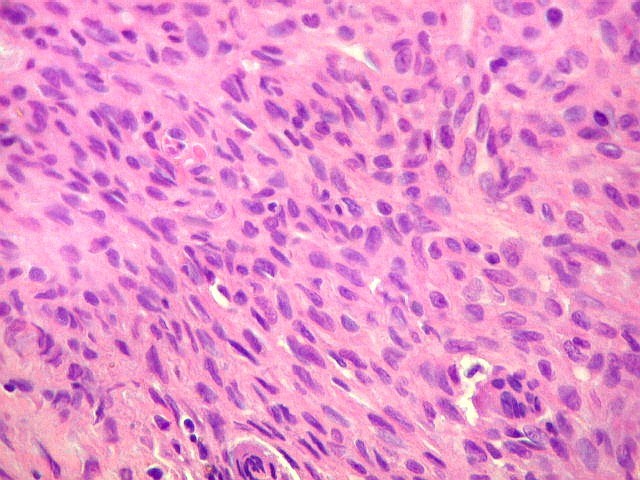
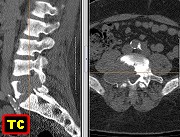
| Biópsia da lesão óssea em vértebra L5. Ver TC. Lesão moderadamente celular, com células gigantes multinucleadas do tipo osteoclasto irregularmente distribuídas entre as células mononucleadas, ditas estromais. Estas não apresentam atipias nucleares, têm citoplasma róseo abundante, contorno arredondado ou fusiforme, por vezes arranjadas em feixes multidirecionados. Observam-se algumas mitoses restritas às células estromais, na maioria típicas. O aspecto geral é indistinguível de um granuloma reparador de células gigantes. |
 |
 |
 |
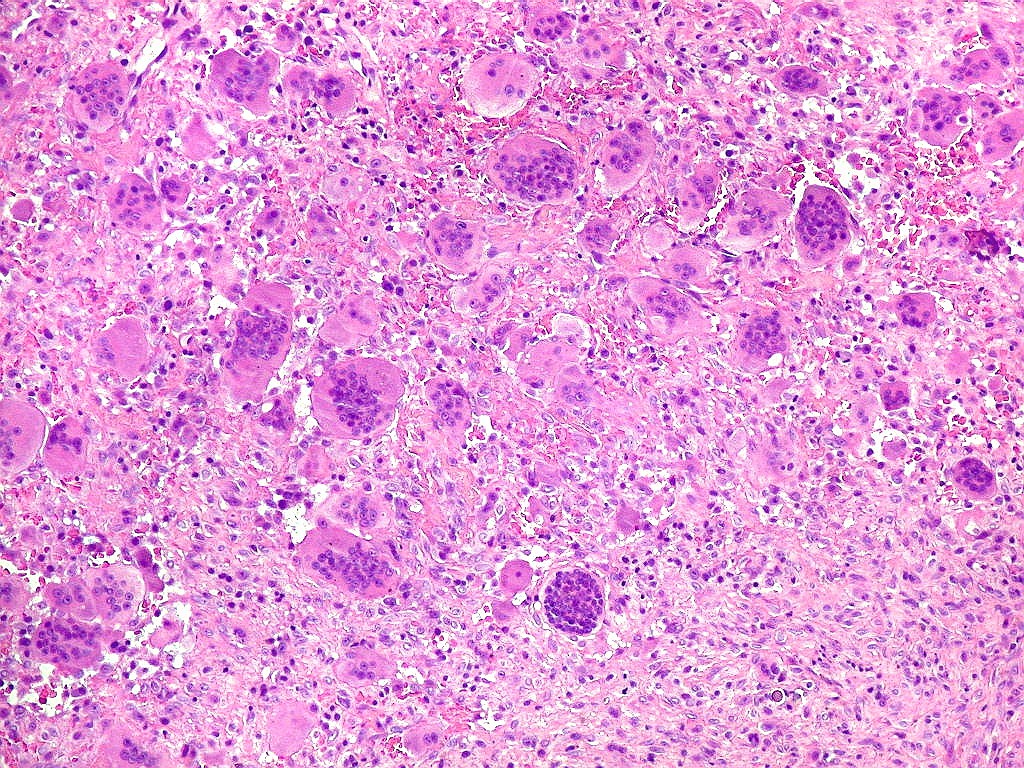 |
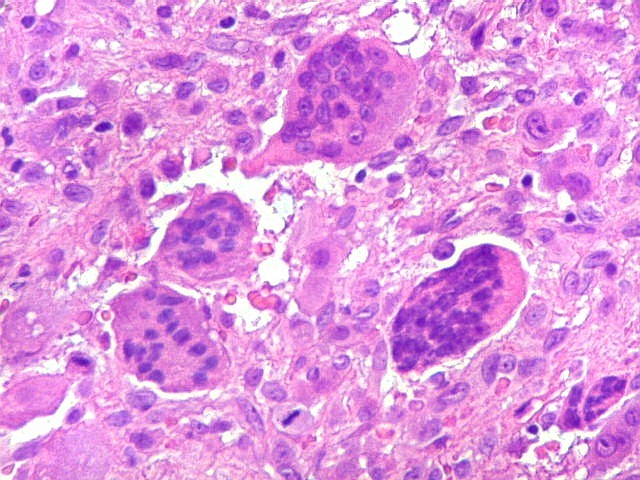
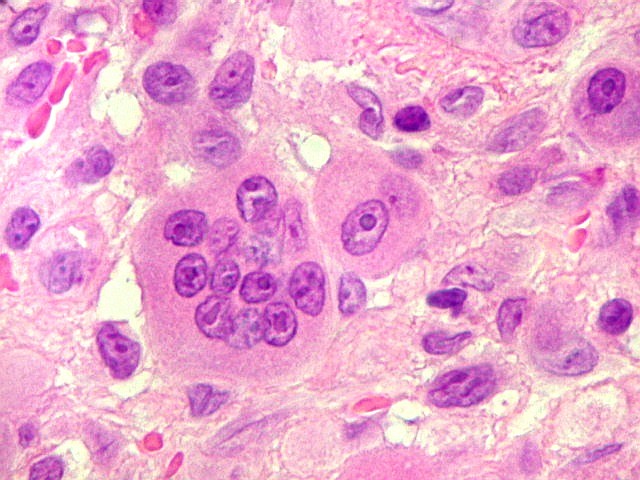
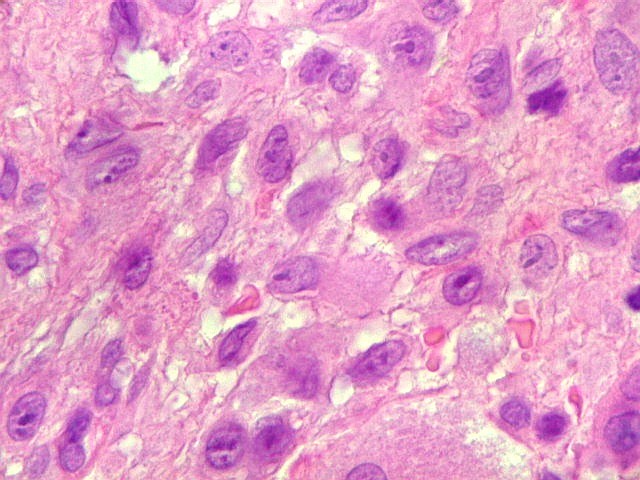
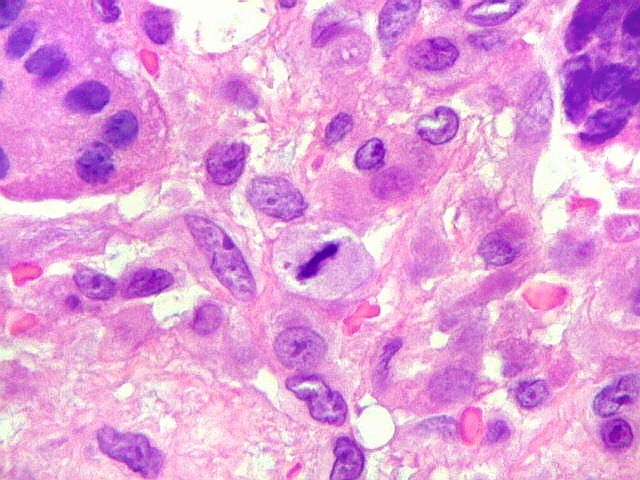
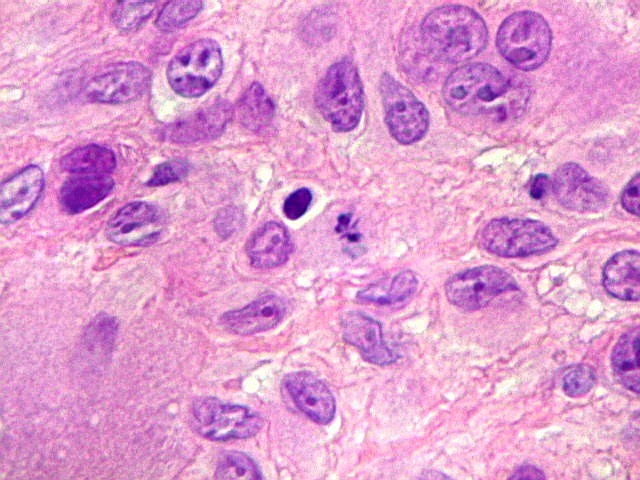
| Células gigantes. São do tipo osteoclasto, com numerosos núcleos redondos densamente agrupados no citoplasma, mais concentrados no centro da célula. Como são de linhagem macrofágica marcam por CD68, mas curiosamente não para HAM56, um outro marcador de macrófagos. | |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
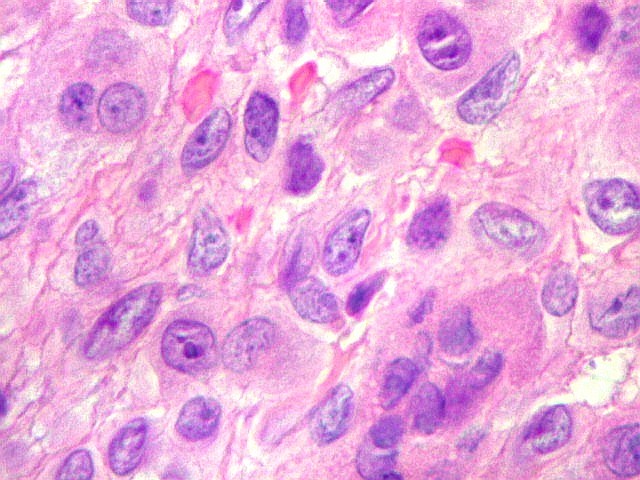
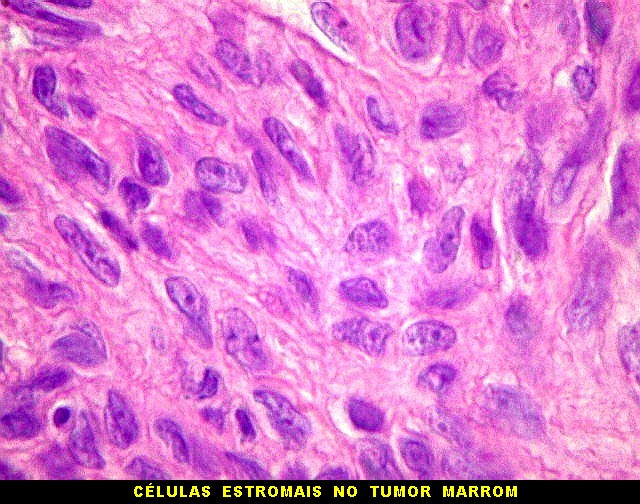
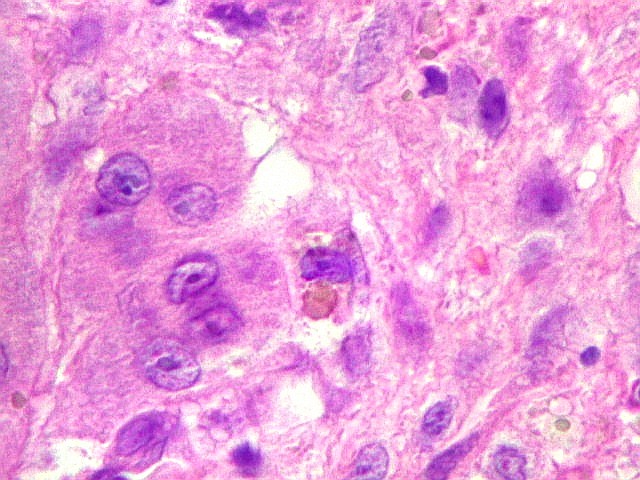
| Células estromais. Estas células de limites imprecisos, por vezes com nucléolo evidente e citoplasma abundante, demonstraram com imunohistoquímica ser em parte macrófagos (positivos para CD68), e em parte miofibroblastos (positivos para 1A4). | |
 |
 |
 |
 |
 |
 |
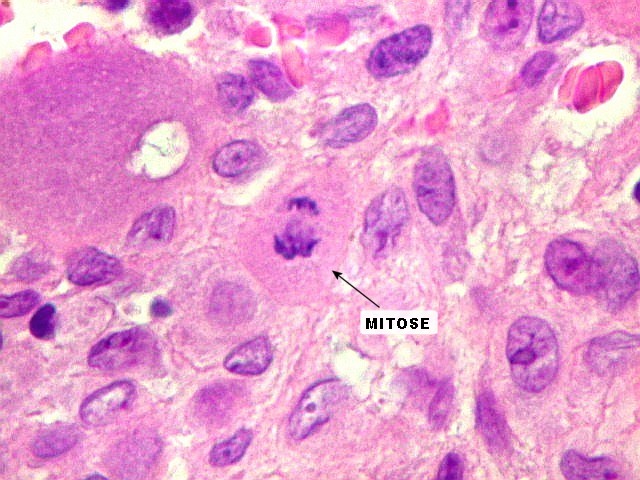
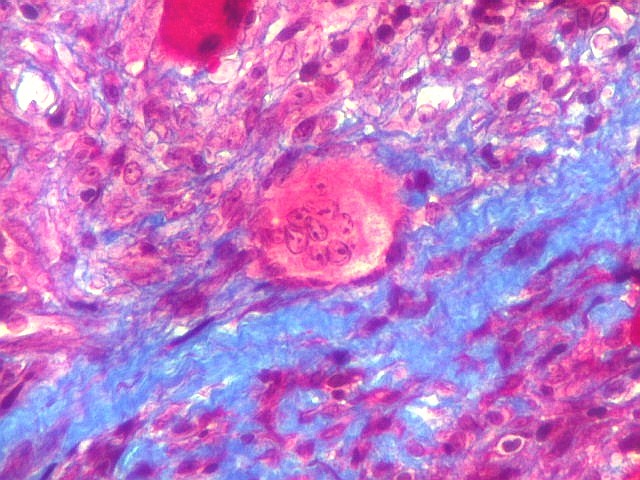
| Mitoses. Geralmente típicas, mas algumas com irregularidades nas placas metafásicas, possivelmente relacionadas ao plano de corte. | |
 |
 |
 |
 |
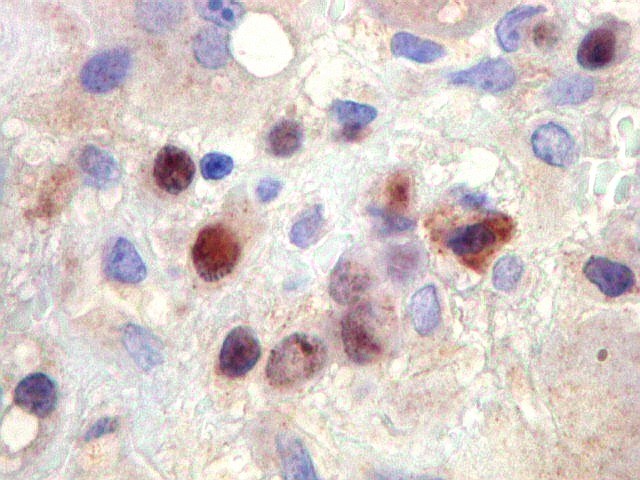
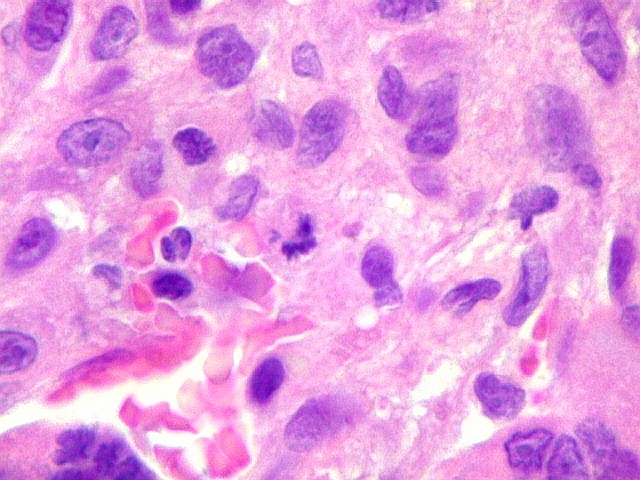
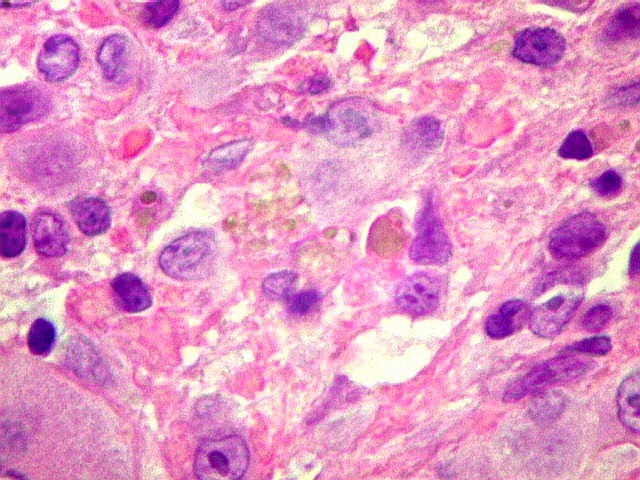
| Hemossiderina. Grânulos de hemossiderina, livres no tecido, ou no citoplasma das células gigantes ou estromais, são atribuídos a sangramentos, e resultam em cor pardacenta, que justifica o termo 'tumor marrom'. | |
 |
 |
 |
 |
 |
 |
|
|
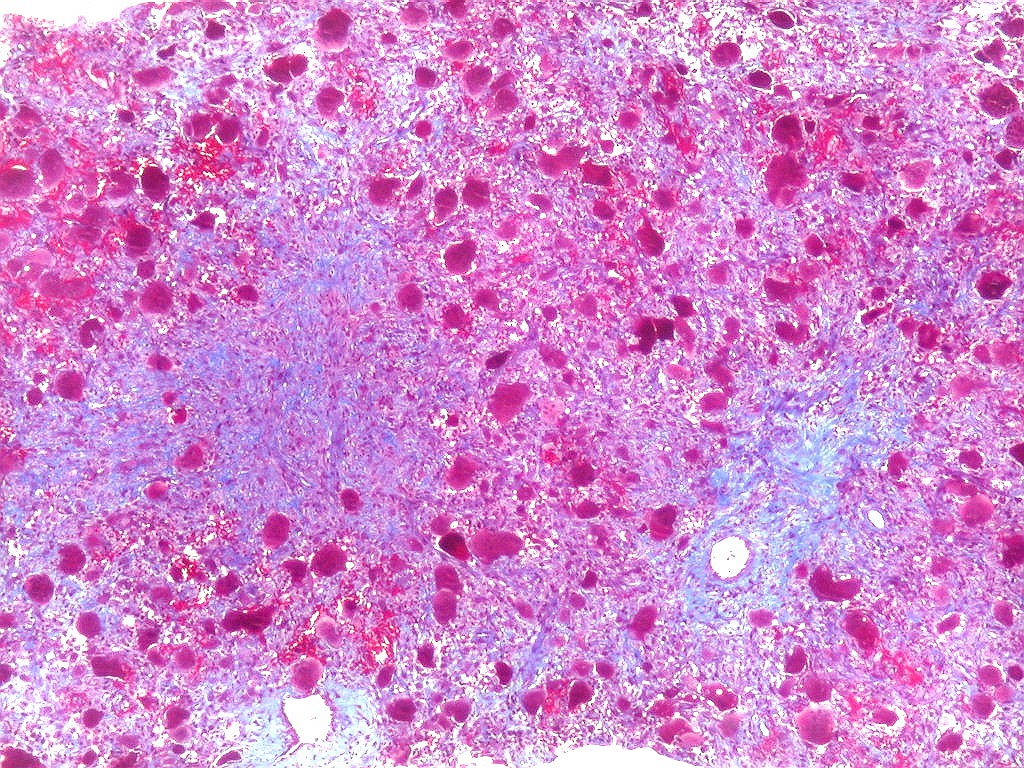
| Tricrômico de Masson. Esta coloração tradicional para tecido conjuntivo (para técnica, clique), que demonstra fibras colágenas em azul e células em vermelho (núcleos em roxo), mostra que parte considerável da lesão é constituída por colágeno. Esta percepção não é possível em HE, onde células e fibras são coradas em róseo. |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
| Agradecimentos. Caso do Hospital das Clínicas da Unicamp. Histologia e coloração especial executadas no Laboratório de Rotina do Departamento de Anatomia Patológica, FCM-UNICAMP, Campinas, SP. |
| Hiperparatiroidismo.
Na forma primária, pode ser devido a um adenoma ou a hiperplasia das paratiróides. A principal característica é aumento do nível sérico de hormônio paratiroidiano (PTH) e de cálcio ionizado e diminuição do nível sérico de fosfato. Em hiperparatiroidismo de longa duração há extensa reabsorção óssea e efeitos renais, como cálculos, nefrocalcinose e infecções urinárias freqüentes. Hiperparatiroidismo em pacientes renais crônicos (secundário) provavelmente se deve a insuficiente ativação da vitamina D no parênquima renal doente, com menor conversão de 25OH-D a 1.25(OH)2-D3 (calcitriol). Isto resulta em absorção ineficiente de cálcio no intestino e aumento da secreção de PTH na 'tentativa' compensatória de manter os níveis do cálcio no fluido extracelular. Calcitriol é o único hormônio que promove a translocação do cálcio contra o gradiente de concentração que existe a nível da membrana da célula intestinal. A absorção de cálcio no intestino é problemática, devido à tendência do íon a formar complexos insolúveis, como fosfato de cálcio, além do que íons divalentes em geral são mal absorvidos. A deficiência de vitamina D (do calcitriol) leva a hipocalcemia, deficiência de formação de osso novo e da remodelação óssea. Vitamina D. Pequenas quantidades estão presentes em alimentos, como peixes, óleo de fígado de bacalhau, gema de ovo). Contudo, a maior parte de vitamina D disponível para síntese de calcitriol (que é a forma ativa) é formada na camada de Malpighi (espinhosa) da epiderme através de uma reação mediada por raios ultravioleta. A reação é diretamente proporcional à intensidade de exposição e inversamente à pigmentação da pele. A partir da pele ou do intestino, a molécula de vitamina D sofre várias transformações químicas em diferentes órgãos, começando pelo fígado (hidroxilação em posição 25), passando inicialmente a 25OH-D3, que é a principal forma de vitamina D encontrada no plasma. Esta é transportada ao rim por uma proteína portadora. No rim, o 25-hidroxicolecalciferol (25OH-D3), que é um agonista fraco, é modificado por hidroxilação na posição C, nas mitocôndrias do túbulo contornado proximal. A reação é complexa, envolvendo várias enzimas e coenzimas, e resulta no 1.25(OH2)D3 (calcitriol), que é o metabólito mais potente da vitamina D. É a falta deste metabólito que leva às conseqüências clínicas da deficiência da absorção intestinal de cálcio. A deficiência de vitamina D na criança resulta em raquitismo, e no adulto em osteomalácia. Há diminuição na absorção de cálcio e fósforo no intestino e dos níveis destes íons no fluido extracelular. Há diminuição da mineralização do osteóide (matriz óssea) e os ossos se tornam estruturalmente fracos. Quando há lesão significativa do parênquima renal, a formação de calcitriol é reduzida, bem como a absorção intestinal de cálcio. A redução da calcemia estimula maior secreção de hormônio paratiroidiano, que atua nos ossos pelo aumento da atividade dos osteoclastos, na ‘tentativa’ de aumentar o nível de cálcio no sangue. Isto leva a reabsorção óssea extensa, um fenômeno conhecido como osteodistrofia renal. O tumor marrom é uma exacerbação deste processo, com formação de agrupamentos de osteoclastos e lise óssea localizada. Tumor marrom do hiperparatiroidismo. O tumor marrom tipicamente ocorre nas diáfises de ossos longos, costelas, mandíbula, metacarpos e pelve. A incidência de tumor marrom em pacientes com doença renal crônica e hiperparatiroidismo secundário é da ordem de 1,5%. Histologicamente é caracterizado por numerosas células gigantes, arranjadas difusamente ou agrupadas, em um fundo de células estromais mononucleares ovaladas ou fusiformes. Vascularização é elevada, e hemossiderina pode ser abundante. São histologicamente indistinguíveis do granuloma reparador de células gigantes (imagem, patologia, texto) e do tumor de células gigantes do osso (imagem, patologia, peça, lâmina). Correlação com estudos clínicos, laboratoriais e radiológicos são essenciais para o diagnóstico correto. O tumor marrom, também chamado osteoclastoma, é uma forma extrema da osteíte fibrosa cística, que é uma manifestação da osteodistrofia renal. Este termo é usado para definir as complicações esqueléticas da insuficiência renal crônica, que é, na sua essência, um distúrbio da remodelação óssea. O principal mecanismo patogenético que leva ao hiperparatiroidismo secundário é a deficiência do 1a,25-dihidroxicolecalciferol (1a,25-dihidroxivitamina D3), levando a hipocalcemia e retenção de fosfato. A hipocalcemia causa aumento da secreção de paratormônio pelas paratiróides. Maiores níveis de PTH resultam em maior reabsorção óssea, que resulta em osteopenia e diminuição da massa óssea. Envolvimento da coluna vertebral e compressão medular pelo tumor marrom do hiperparatiroidismo são extremamente raros e geralmente ocorrem no hiperparatiroidismo primário. Há poucos casos relatados em pacientes com doença renal crônica e hiperparatiroidismo secundário. Uma revisão de literatura de 2013 (Fargen et al) encontrou 30 casos de tumor marrom vertebral resultando em déficit neurológico. A maioria ocorreu em mulheres (63%) entre 40 a 49 anos, na coluna torácica e em proporções semelhantes no hiperparatiroidismo primário e secundário. Principal referência. Mourelatos Z et al. Final Diagnosis: Brown Tumor (Giant Cell Tumor Of Hyperparathyroidism). 2018 UPMC | University of Pittsburgh Medical Center. Pittsburgh, Pennsylvania. https://path.upmc.edu/index.html Outras
Livro texto – Daryl K. Granner. Hormones that regulate calcium metabolism. Chapter 47 in Harper’s Biochemistry. 23rd Ed. Murray RK et al (eds). Lange Medical Books, Appleton & Lange, Norwalk, Connecticut, 1993, p 515-22. |
| Para mais imagens deste caso : | TC | HE, Masson | IH - CD68, HAM5.6, 1A4, vimentina, CD34, Ki67. |
 |
 |
 |
|
imagem, patologia |
|
|
|
|
| Neuropatologia
- Graduação |
Neuropatologia -
Estudos de casos |
Neuroimagem
- Graduação |
Neuroimagem -
Estudos de Casos |
Roteiro
de aulas |
Textos
de apoio |
Correlação
Neuropatologia - Neuroimagem |
| Índice alfabético - Neuro | Adições recentes | Banco de imagens - Neuro | Textos ilustrados | Neuromuscular | Patologia - outros aparelhos | Pages in English |
|
|
|
|